
【题目】下列物质中,互为同分异构体的是( )
A. 淀粉和麦芽糖 B. 果糖和葡萄糖 C. 蛋白质和氨基酸 D. 蔗糖和葡萄糖
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、 MgSiO3以及铁和铝的氧化物)为原料制备MgCO33H2O。实验流程如下: [已知当溶液的pH=8.5时, Mg(OH)2开始沉淀]
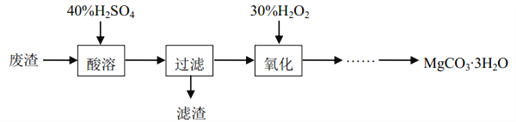
(1)滤渣的主要成分是______(填化学式)。
(2)氧化的目的是__________。
(3)由氧化后得到的溶液经除杂后,滴加适量的Na2CO3溶液便可制得MgCO33H2O。滴加Na2CO3溶液时,不能太快也不能过量的原因是_______________。
(4)通过测定产品中的镁含量和碳含量可判断质量的优劣。现称取3.00 g某学生制得的产品溶于足量的稀盐酸中收集到448 mLCO2气体(假设气体全部逸出并折算为标准状况 ),再将所得溶液稀释至250 mL,取 出25 mL,向其中滴加0.1000 mol·L-1的EDTA(Na2H2Y)溶液至恰好完全反应时消耗体积为23.10 mL。(离子方程式为Mg2++H2Y2-=MgY2-+2H+)通过计算,分别确定镁含量和碳含量比理论值偏高还是偏低?_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中所描述的物质一定是金属元素的是( )
A. 易得到电子的元素 B. 原子最外层只有一个电子的元素
C. 单质具有金属光泽的元素 D. 第三周期中,原子的最外层上只有2个电子的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置. 
请回答下列问题:
(1)装置F中发生反应的离子方程式为 .
(2)装置A的烧瓶中可装试剂
(3)B装置的名称是 , E装置的作用 .
(4)通入C装置的两根导管左边较长、右边较短,目的是 .
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.写出反应的化学方程式:该反应中氧化剂和还原剂的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列反应:①NH4HCO3溶液与石灰水反应、②K2SO3溶液与稀盐酸反应,③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是( )。
A. ①②③ B. ①②④
C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写:
(1)在H2O、NaCl、NaOH、Na2O2、H2O2中,既含有非极性键又含有极性键的是 , 既含有离子键又含有极性键的是;
(2)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
工业生产甲醇的常用方法是:CO(g)+2H2 (g)CH3OH(g)△H=﹣91.0kJ/mol ①
已知:2H2 (g)+O2 (g)═2H2O (l)△H=﹣572.0kJ/mol ②
H2 (g)+ ![]() O2 (g)═H2O(g)△H=﹣263.0kJ/mol ③
O2 (g)═H2O(g)△H=﹣263.0kJ/mol ③
①H2的燃烧热为 kJ/mol.
②CH3OH(g)+O2 (g)CO(g)+2H2O(g)的反应热△H=kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 该温度下此反应的平衡常数K=1.44
B. 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
D. 0~2min的平均速率ν(Z)=2.0×10﹣3molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com