
【题目】实验室以一种工业废渣(主要成分为MgCO3、 MgSiO3以及铁和铝的氧化物)为原料制备MgCO33H2O。实验流程如下: [已知当溶液的pH=8.5时, Mg(OH)2开始沉淀]
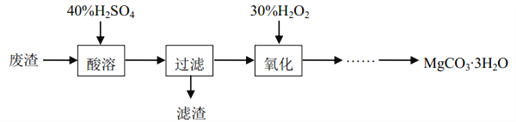
(1)滤渣的主要成分是______(填化学式)。
(2)氧化的目的是__________。
(3)由氧化后得到的溶液经除杂后,滴加适量的Na2CO3溶液便可制得MgCO33H2O。滴加Na2CO3溶液时,不能太快也不能过量的原因是_______________。
(4)通过测定产品中的镁含量和碳含量可判断质量的优劣。现称取3.00 g某学生制得的产品溶于足量的稀盐酸中收集到448 mLCO2气体(假设气体全部逸出并折算为标准状况 ),再将所得溶液稀释至250 mL,取 出25 mL,向其中滴加0.1000 mol·L-1的EDTA(Na2H2Y)溶液至恰好完全反应时消耗体积为23.10 mL。(离子方程式为Mg2++H2Y2-=MgY2-+2H+)通过计算,分别确定镁含量和碳含量比理论值偏高还是偏低?_____。
【答案】 H2SiO3 将 Fe2+氧化成 Fe3+,便于后续除去 防止产生 Mg(OH)2 理论上, MgCO33H2O 中镁和碳的质量分数分别为 0.1739 和 0.087,产品中,镁的质量分数为 0.1848>0.1739,比理论值高;碳的质量分数为 0.080<0.087,比理论值低。
【解析】(1)废渣(主要成分为MgCO3、 MgSiO3以及铁和铝的氧化物)与硫酸反应,生成可溶性硫酸盐和难溶于水的硅酸,则滤渣为H2SiO3;(2)氧化的目的是将亚铁离子氧化为铁离子,为后续除去做准备;(3)因Na2CO3溶液呈碱性,除含有大量碳酸根离子外,还有水解生成的氢氧根离子,太快滴加Na2CO3溶液,可能会有Mg(OH)2沉淀生成,引入杂质;(4)理论上, MgCO33H2O 中镁和碳的质量分数分别为 0.1739 和 0.087,通过二氧化碳体积求出碳元素的物质的量,由离子方程式Mg2++H2Y2-=MgY2-+2H+中Mg2+与H2Y2-按1:1反应,可计算产品中,镁的质量分数为 0.1848>0.1739,比理论值高;碳的质量分数为 0.080<0.087,比理论值低。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】现将浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=60mL)。下列叙述错误的是 ( )

A. 实验的环境温度低于22℃ B. 混合溶液的导电能力:M>N
C. P点混合溶液呈中性 D. 若将H2SO4改为CH3COOH,P点温度低于28℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用均正确的是( )
A.SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
B.Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C.氨气是一种碱性气体,可用碱石灰或无水CaCl2干燥
D.MgO的熔点很高,可用于制作耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
(1)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
在200℃时,当测得NH3和N2、H2的物质的量分别为1mol和0.5mol、1mol时,则该反应的v(N2)正____v(N2)逆(填写“>”、“=”或“<”)。
(2)结合表中给出的电离常数回答下列问题:
酸或碱 | CH3COOH | HNO2 | HCN | HClO |
电离平衡常数(Ka或Kb) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
①上述四种酸中,酸性最弱、最强的酸分别是_______、____(用化学式表示)。
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是____(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com