
【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
(1)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
在200℃时,当测得NH3和N2、H2的物质的量分别为1mol和0.5mol、1mol时,则该反应的v(N2)正____v(N2)逆(填写“>”、“=”或“<”)。
(2)结合表中给出的电离常数回答下列问题:
酸或碱 | CH3COOH | HNO2 | HCN | HClO |
电离平衡常数(Ka或Kb) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
①上述四种酸中,酸性最弱、最强的酸分别是_______、____(用化学式表示)。
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是____(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式_______。
【答案】 > HCN HNO2 BE CH3COOH + ClO-= HClO + CH3COO-
【解析】试题分析:本题考查化学平衡常数的影响因素及应用,外界条件对弱电解质电离平衡的影响,电离平衡常数的应用。
(1)因为正反应的ΔH![]() 0,升高温度平衡逆向移动,化学平衡常数减小,则K1
0,升高温度平衡逆向移动,化学平衡常数减小,则K1![]() K2
K2![]() 0.5。在200℃时,当测得NH3和N2、H2的物质的量分别为1mol和0.5mol、1mol时,此时浓度商Q=(1mol
0.5。在200℃时,当测得NH3和N2、H2的物质的量分别为1mol和0.5mol、1mol时,此时浓度商Q=(1mol![]() 0.5L)2/[(0.5mol
0.5L)2/[(0.5mol![]() 0.5L)
0.5L)![]() (1mol
(1mol![]() 0.5L)3]=0.5
0.5L)3]=0.5![]() K1,反应正向进行,则该反应的υ(N2)正
K1,反应正向进行,则该反应的υ(N2)正![]() υ(N2)逆。
υ(N2)逆。
(2)①四种酸的电离平衡常数由大到小的顺序为:HNO2![]() CH3COOH
CH3COOH![]() HClO
HClO![]() HCN,酸性最弱的为HCN,酸性最强的为HNO2。
HCN,酸性最弱的为HCN,酸性最强的为HNO2。
②CH3COOH电离方程式为CH3COOH![]() CH3COO-+H+。A项,弱酸的电离是吸热过程,升高温度,电离平衡正向移动,CH3COOH的电离程度增大,电离平衡常数也增大;B项,加水稀释促进弱酸的电离,CH3COOH的电离程度增大,由于温度不变,电离平衡常数不变;C项,加少量的CH3COONa固体,增大CH3COO-的浓度,平衡逆向移动,CH3COOH的电离程度减小,温度不变电离平衡常数不变;D项,加少量冰醋酸,CH3COOH的电离程度减小,温度不变电离平衡常数不变;E项,加氢氧化钠固体,NaOH电离的OH-与H+中和,H+浓度减小,电离平衡正向移动,CH3COOH的电离程度增大,温度不变电离平衡常数不变;答案选BE。
CH3COO-+H+。A项,弱酸的电离是吸热过程,升高温度,电离平衡正向移动,CH3COOH的电离程度增大,电离平衡常数也增大;B项,加水稀释促进弱酸的电离,CH3COOH的电离程度增大,由于温度不变,电离平衡常数不变;C项,加少量的CH3COONa固体,增大CH3COO-的浓度,平衡逆向移动,CH3COOH的电离程度减小,温度不变电离平衡常数不变;D项,加少量冰醋酸,CH3COOH的电离程度减小,温度不变电离平衡常数不变;E项,加氢氧化钠固体,NaOH电离的OH-与H+中和,H+浓度减小,电离平衡正向移动,CH3COOH的电离程度增大,温度不变电离平衡常数不变;答案选BE。
③由于酸性CH3COOH![]() HClO,根据“强酸制弱酸”的复分解反应规律,醋酸和次氯酸钠溶液能反应,反应的离子方程式为CH3COOH + ClO-= HClO + CH3COO-。
HClO,根据“强酸制弱酸”的复分解反应规律,醋酸和次氯酸钠溶液能反应,反应的离子方程式为CH3COOH + ClO-= HClO + CH3COO-。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:

回答下列问题:
(1)Ni2O3中Ni的化合价为___________________________________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是_________________________。
(3)加入H2O2“氧化”的离子方程式为_________________________________________;滤渣A的主要成分是________________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________________________________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、 MgSiO3以及铁和铝的氧化物)为原料制备MgCO33H2O。实验流程如下: [已知当溶液的pH=8.5时, Mg(OH)2开始沉淀]
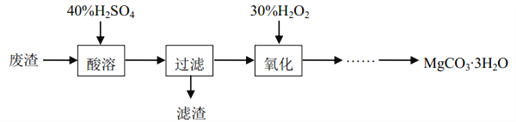
(1)滤渣的主要成分是______(填化学式)。
(2)氧化的目的是__________。
(3)由氧化后得到的溶液经除杂后,滴加适量的Na2CO3溶液便可制得MgCO33H2O。滴加Na2CO3溶液时,不能太快也不能过量的原因是_______________。
(4)通过测定产品中的镁含量和碳含量可判断质量的优劣。现称取3.00 g某学生制得的产品溶于足量的稀盐酸中收集到448 mLCO2气体(假设气体全部逸出并折算为标准状况 ),再将所得溶液稀释至250 mL,取 出25 mL,向其中滴加0.1000 mol·L-1的EDTA(Na2H2Y)溶液至恰好完全反应时消耗体积为23.10 mL。(离子方程式为Mg2++H2Y2-=MgY2-+2H+)通过计算,分别确定镁含量和碳含量比理论值偏高还是偏低?_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质量是
A. 16 g B. 32 g C. 64 g /mol D. 32 g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂综合处理含 NH4+废水和工业废气(主要含 N2、CO2、SO2、NO、CO,不考虑其他成分),设计的流程如下图,回答下列问题:
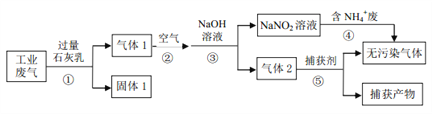
(1)固体 1的主要成分有______(填化学式)。
(2)反应①需控制反应的温度和气体的流速,其共同目的是______。
(3)反应④的离子方程式为______。
(4)已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O
在同温同压下,当反应②中NO与空气的体积比为______,经反应③,气体中NOx被完全吸收且仅生成 NaNO2。(设空气中氧气所占体积分数为 0.2)
(5)CuCl 的氨溶液常用作反应⑤的捕获剂。将(NH4)2SO3、NH4Cl与CuSO4 3种溶液相混可制得难溶物 CuCl。
① 理论上,(NH4)2SO3与CuSO4恰好反应时,n(SO32-):n(Cu2+)=______。
② 实际上, (NH4)2SO3的用量与 Cu2+的沉淀率关系如图所示,显然Cu2+沉淀率最高时,(NH4)2SO3的用量高于理论值其原因是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是()。

A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后.向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280mL(标准伏况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中所描述的物质一定是金属元素的是( )
A. 易得到电子的元素 B. 原子最外层只有一个电子的元素
C. 单质具有金属光泽的元素 D. 第三周期中,原子的最外层上只有2个电子的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置. 
请回答下列问题:
(1)装置F中发生反应的离子方程式为 .
(2)装置A的烧瓶中可装试剂
(3)B装置的名称是 , E装置的作用 .
(4)通入C装置的两根导管左边较长、右边较短,目的是 .
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.写出反应的化学方程式:该反应中氧化剂和还原剂的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 该温度下此反应的平衡常数K=1.44
B. 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
D. 0~2min的平均速率ν(Z)=2.0×10﹣3molL﹣1min﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com