
����Ŀ��ij��ѧ��ȤС��ⶨijFe2(SO4)3��Ʒ(ֻ������FeCl2����)����Ԫ�ص�����������������ʵ�鲽����в�����
�ٳ�ȡag��Ʒ�������ձ��У�
�ڼ���50 mL 1.0 mol/Lϡ�����һ����������ˮ��ʹ��Ʒ�ܽ⣬Ȼ��ȷ���Ƴ�250.0 mL��Һ��
����ȡ25.0 mL���������õ���Һ�������ձ��У�������������ˮ��ʹ��Ӧ��ȫ��
�ܼ��������ˮ����ֽ��裬ʹ������ȫ��
�ݹ��ˣ�ϴ�ӳ�����
������ת�Ƶ�ij�����ڣ����ȡ����裬ֱ�������ɺ��ɫȫ����Ϊ����ɫ���ڸ���������ȴ�����º�����
������

����������������ش�
��1����ͼ��ʾ�����У���ʵ�鲽��٢ڢ��б����õ���������E��________(����ĸ)��
��2��������У�����50 mL��1.0 mol/LϡH2SO4��Ҫ98%(�ܶ�1.84 g/cm3)��ŨH2SO4���Ϊ________ mL����ȡ�������ŨH2SO4�õ���Ͳ�����________��
��3����Ʒ�е�����Fe2���н�ǿ�Ļ�ԭ�ԣ���ɲ���ƽ���з�Ӧ�����ӷ���ʽ![]() Fe2����
Fe2����![]() ClO2��
ClO2��![]()
![]() ===
===![]() Fe3����
Fe3����![]() Cl����
Cl����![]() H2O__________________���������Ϸ���������ʵ����������ˮ��ΪClO2ʱ����ʵ������Ӱ����__________(����ƫ������ƫС��������Ӱ����)�������ʵ���ClO2��Cl2������Ч��֮��Ϊ__________��
H2O__________________���������Ϸ���������ʵ����������ˮ��ΪClO2ʱ����ʵ������Ӱ����__________(����ƫ������ƫС��������Ӱ����)�������ʵ���ClO2��Cl2������Ч��֮��Ϊ__________��
��4���ڢ��IJ����У���������ת�Ƶ�________(����������)�м��ȣ���ȴ�����£�����������Ϊm1g���ٴμ��Ȳ���ȴ�����³���������Ϊm2g����m1��m2��ֵ�ϴ������IJ���Ӧ����________________��
(5)��������ڸ���������ȴ����ⶨ����Ԫ�ص�����������________(����ƫ������ƫС��������Ӱ����)��������������W1g�����������������������W2g������Ʒ����Ԫ�ص���������Ϊ________(�г���ʽ�����軯��)��
���𰸡�CFG 2.7 10 mL 5��1��4H��===5��1��2 ��Ӱ�� 5��2 ���� �������ȣ����ø���������ȴ����������������γƵõ����������0.1 g(�����)Ϊֹ ƫ�� ![]() ��2��56 g/mol��
��2��56 g/mol��![]() ��ag��100%
��ag��100%
��������
��1�����ݸ�����������ѡȡ������
��2������������Һϡ���������ʵ����������������Һ�����
��3������������ԭ��Ӧ�����غ㡢ԭ���غ���ƽ���ӷ���ʽ����ԭ��һ������Ҫ�������������������������ƣ���ԭ��ʧ������һ�����������ı䲻Ӱ������������������������ǵõ�������֮�ȣ�
��4����������ڸ���������ȴ�������տ����е�ˮ����������������������ⶨ����Ԫ�ص���������ƫ�ߣ���������ֱ�������ɺ��ɫȫ����Ϊ����ɫ��������������صı������γ�������������0.1g��
��5����������ڸ���������ȴ�������տ����е�ˮ����������������������ⶨ����Ԫ�ص���������ƫ��
��1������ҩƷ����ƽ���Ȼ������Ȼ�������ˮ��Һ�������ԣ�����ȷ��ȡ25.00mL���������õ���Һ����ʽ�ζ��ܣ�����һ�����ʵ���Ũ�ȵ���Һ������ƿ���ʴ�Ϊ��CFG��
��2������50mL��1.0mol/LϡH2SO4��Ҫ98%���ܶ�1.84g/cm3����ŨH2SO4���Ϊ��ΪVml������ϡ��ǰ����Һ�������ʵ������䣬 ![]() =0.05L��1.0mol/L��V=2.7ml�������õ�����Ͳ���Ϊ10ml��
=0.05L��1.0mol/L��V=2.7ml�������õ�����Ͳ���Ϊ10ml��
��3����Ӧ�У��������ӱ仯Ϊ�����ӣ�������������Ԫ�ػ��ϼ۴�+4�۱仯Ϊ-1�ۣ��仯5�ۣ�����ת����С������Ϊ5�����ݵ����غ��ԭ���غ���ƽ�õ����ӷ���ʽΪ��5Fe2++ClO2+4H+�T5Fe3++Cl-+2H2O���������Ϸ���������ʵ����������ˮ��ΪClO2ʱ��ʵ����Ӱ�죬��ͬ������������ͬ��ͬ����ԭ�����ʱ�������Ҫʧȥ������ͬ�������ʵ�����ClO2��Cl2������Ч��֮��Ϊת�Ƶ�����֮�ȣ�ClO2��Cl-��5e-��Cl2��2Cl-��2e-������1molClO2��Cl2������Ч��֮��Ϊ5��2��
��4������Ӧ���������н��м��ȣ���m1��m2��ֵ�ϴ��������ȣ���ȴ����������������ε����������0.1gΪֹ���ʴ�Ϊ�����������ȣ���ȴ����������������ε����������0.1gΪֹ��
��5����������ڸ���������ȴ�������տ����е�ˮ����������������������ⶨ����Ԫ�ص���������ƫ������Ԫ�������غ㣬������ɫ�����е���������Ʒ������Fe2O3����Ԫ�ص�����Ϊ��W2-W1��g![]()
![]() ����Ʒ����Ԫ�ص�����������
����Ʒ����Ԫ�ص�����������![]() ��2��56 g/mol��
��2��56 g/mol��![]()
![]() ag��100%��
ag��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�еĵ�������Ҫ����κ������ε���ʽ���ڣ����õ�ⷨ����Һ�г�ȥ����Cl������ʱ������ԭ����ͼ1��ʾ����Ҫ������Ч�ȣ�HClO��ClO������NH4����NH3����ΪN2���ڲ�ͬpH�����½��е��ʱ������ȥ���ʺ�ˮ����Ч��Ũ������ҺpH�Ĺ�ϵ��ͼ2��ʾ��
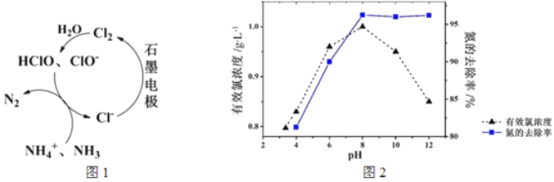
����˵������ȷ����
A. pH��3ʱ����Ҫ����ClO������NH3�ķ�Ӧ
B. pH>8ʱ����Ч��Ũ����pH���������С
C. pH>8ʱ��NH4��ת��ΪNH3��H2O����������NH3�ݳ�
D. pH<8ʱ������ȥ������pH�ļ��ٶ��½���ԭ����c(HClO)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���͵�أ���NaBH4(B�Ļ��ϼ�Ϊ��3��)��H2O2��ԭ�ϣ��õ�ؿ�������ˮ��̽������������Դ���乤��ԭ����ͼ��ʾ������˵����ȷ����
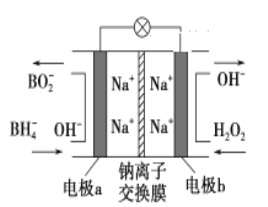
A. ��ع���ʱNa����b��������a����
B. a���ϵĵ缫��ӦʽΪ��BH4����8OH����8e��===BO2����6H2O
C. ÿ����3 mol H2O2��ת��3 mol e��
D. b���ϵĵ缫��ӦʽΪ��H2O2��2e����2H��===2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ��谱�����ƵĻ�ѧ����ʽΪCaCO3+2HCN![]() CaCN2+CO��+H2��+CO2��,����˵����ȷ����
CaCN2+CO��+H2��+CO2��,����˵����ȷ����
A. ��Ԫ�ر�����, ̼Ԫ�ر���ԭ
B. HCN������, CaCO3����ԭ
C. HCN��������, CaCO3�ǻ�ԭ��
D. CaCN2����������, H2Ϊ��ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҿ�����һ�ֵͳɱ��������������״ʯīϩ������ԭ����Na2O+2CO  Na2CO3+C(ʯīϩ����Ȼ���ȥNa2CO3,�����Ƶ÷���״ʯīϩ������˵������ȷ���ǣ� ��
Na2CO3+C(ʯīϩ����Ȼ���ȥNa2CO3,�����Ƶ÷���״ʯīϩ������˵������ȷ���ǣ� ��
A.������ʯīϩ�ķ�Ӧ����������ԭ��Ӧ
B.ʯīϩ����ʯ��Ϊͬ��������
C.Na2O���ڼ��������CO�������������Na2CO3������
D.��Ȼ������Ԫ���Ի���̬��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ��װ�õĿ�ѧ�����ʵ���Ƿ�ȡ��Ԥ��Ч���Ĺؼ�����ش������й�ʵ��װ�õ�������⣺
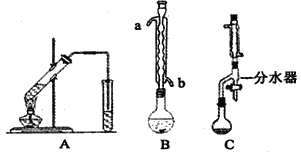
I��ͼAΪ�̲��Ʊ�����������ʵ��װ�ã���ͬѧ��ΪͼBװ�ñ�AҪ�ã�����ȴˮӦ��_______�ڽ��룻��ͬѧ��ΪͼCװ��Ч�����ã�������________________��
����Ħ������[(NH4)2Fe(SO4)2��6H2O]�Ƿ�����ѧ�е���Ҫ�Լ�����֪��Ħ���θ�������������500��ʱ����ȫ�ֽ⡣ijѧϰС����̽����ֽ���
��1����������룩С��ͬѧ��Ϊ�ֽ������������¼��������
A��Fe2O3SO2NH3H2O B��FeO SO3NH3H2O
C��FeO SO2NH3H2O D��Fe2O3SO3SO2NH3H2O
������ѧ֪ʶ����ȷ��______________������(�����)
��2����ҩƷ�鴿����ͬѧ���������ʪ��ĺ�ɫʯ����ֽ��ϡ�����__________��Һ�������Ħ�������е��������ӣ�ȡһ��������Ħ�����������Һ��ȡ������Һ�����Թ��У������еμ�______________(���Լ����ƺ�ʵ������)������Ħ������δ�����������ʡ�
��3����ʵ��̽����Ϊ����ֽ�����ͬѧ���������ʵ��װ�á�

��ȡһ������Ħ���������ڼ��ȹ�A�У��������ֽ���ȫ���K����ͨ��N2��Ŀ����__________��
��ʵ���й۲쵽A�й�����Ϊ����ɫ��B��C�о�������ɫ������C�з�����Ӧ�����ӷ���ʽΪ_____��
��ʵ����֤ȡA�в�������������ϡ�����ܽ⣬�ٵ���KMnO4ϡ��Һ������ɫ֤�����ﲻ��_______��
��4����ʵ������뷴˼��ͨ��ʵ����������淴˼������������һ����ȷ����_________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ŷŵ�SO2�����Ի��������Ⱦ��ij��ҵ����ͼ�����ۺϴ����������й�˵����ȷ����

A. ���������������з����ķ�ӦΪSO2��SO32����H2O=2HSO3��
B. �����������з����ķ�ӦΪHSO3����OH��=H2O��SO32��
C. �����������õ���������ԭ��Ӧԭ��
D. �������̿�ѭ�����õ�������2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�鹹�뽫����β����NO��NO2��ת��Ϊ��Ҫ�Ļ���ԭ��HNO3����ԭ����ͼ��ʾ������A��BΪ��ײ���.����˵����ȷ����
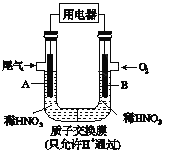
A. �缫A���淴Ӧ֮һΪNO2��e��+H2O= NO3_+2H+
B. �缫B������c(NO3_)����
C. �������Һ�е����ķ�����B��A�����ӵ�������֮�෴
D. �õ�ع���ʱ��ÿת��4mol���ӣ�����22.4L O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У��������Ĵ������Ӧ���ͣ�������������ԭ��Ӧ����
A. 2Na+2H2O===2NaOH+H2��
B. Cl2+H2O===HCl+HClO
C. CaCO3![]() CaO+CO2��
CaO+CO2��
D. Ca��ClO��2+2HCl===CaCl2+2HClO
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com