
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐的形式存在,可用电解法从溶液中除去。有Cl-存在时。除氮原理如图1所示。主要依靠有效氯(HClO、ClO-)将NH4+或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度与溶液pH的关系如图2所示。
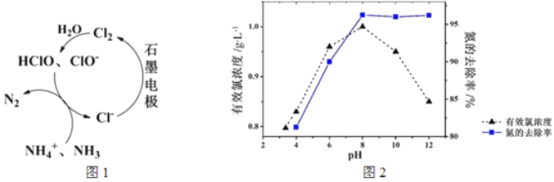
下列说法不正确的是
A. pH=3时,主要发生ClO-氧化NH3的反应
B. pH>8时,有效氯浓度随pH的增大而减小
C. pH>8时,NH4+转变为NH3·H2O,且有利于NH3逸出
D. pH<8时,氮的去除率随pH的减少而下降的原因是c(HClO)减小
【答案】A
【解析】
A、pH=3时,有效氯主要以HClO存在,主要发生HClO氧化NH3的反应,反应后,次氯酸被还原为氯离子,离子反应方程式为:3HClO+2NH4+=3Cl-+N2+3H2O+5H+,故A错误;
B、根据图像,pH>8时,有效氯浓度随pH的增大而减小,故B正确;
C、当pH>8时,有效氯浓度下降,而氮的去除率却并未明显下降,可能的原因是:pH升高有利于NH4+转变为NH3,NH3可直接在电极上放电而氧化(或pH升高有利于NH4+转变为NH3,且有利于NH3逸出),故C正确;
D、当pH<8时,氮的去除率随pH的降低而下降,结合平衡移动原理,可能的原因是:随溶液pH降低,c(H+)增大,Cl2+H2OH++Cl-+HClO平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降,故D正确;
故选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲醇CH3OH)是一种重要的化工原料,工业上有多种方法可制得甲醇成品
(一)以CO、H2和CO2制备甲醇
①CO2(g)+H2(g)![]() COg)+H2O(g) H1
COg)+H2O(g) H1
②CO(g)+2H2 (g) ![]() CH3OH(g) △H2
CH3OH(g) △H2
③CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
(1)已知:反应①的化学平衡常数K和温度的关系如下表
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列说法正确的是______
A.反应①正反应是吸热反应
B.一定体积的密闭容器中,压强不再变化时,说明反应①达到平衡状态
C.1100℃时,反应①的K可能为1.5
D.在1000℃时,[c(CO2)·c(H2)]/[c(CO)·c(H2O)]约为0.59
(2)比较△H2_____△H3(填“>”、“=”或“<”)
(3)现利用②和③两个反应合成CH3OH,已知CO可使反应的催化剂寿命下降若氢碳比表示为f=[n(H2)-n(CO2)]/[n(CO)+n(CO2)],则理论上f=_____时,原料气的利用率高,但生产中住往采用略高于该值的氯碳比,理由是_________________________________.
(二)以天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2Og) ![]() CO(g)+3H2(g) H1>0
CO(g)+3H2(g) H1>0
(ii)合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) H2>0
CH3OH(g) H2>0
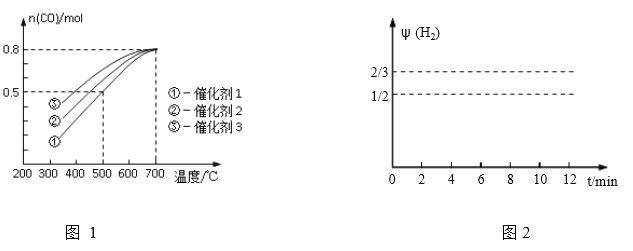
在一定压强下,1 mol CH4(g)和1 mol H2O(g)在三种不同催化剂作用下发生反应(i),经历相同时间时,CO的物质的量(n)随温度变化的关系如图1
(1)下列说法正确的是_______
A.曲线①中n(CO)随温度变化的原因是正反应为吸热反应,升高温度,平衡向右移动
B.三种催化剂中,催化剂③的催化效果最好,所以能获得最高的产率
C.当温度低于700℃时的曲线上的点可能都没有到达平衡
D.若温度大于700℃时,CO的物质的量保持不变
(2)500℃时,反应(1)在催化剂①的作用下到10mim时达到平衡,请在图2中画出反应(1)在此状态下0至12分钟内反应体系中H2的体积分数![]() (H2)随时间t变化的总趋势___________________
(H2)随时间t变化的总趋势___________________
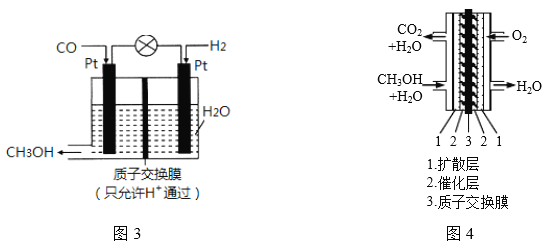
(三)研究表明,CO也可在酸性条件下通过电化学的方法制备甲醇,原理如图3所示。
(1)产生甲醇的电极反应式为___________________;
(2)甲醇燃料电池应用很广,其工作原理如图4,写出电池工作时的负极反应式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某植物叶绿体结构和功能的示意图。请分析回答问题:
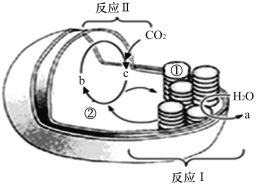
(1)物质a是____________,物质b是________________。
(2)光合作用的光反应阶段发生在_______(填“Ⅰ”或“Ⅱ”),该反应将光能转变为__________________。
(3)叶绿体增加膜面积的方式是____________________________________。在适宜光照和温度条件下培养,由①处转移至②处的物质主要是_____________________。
(4)该植物进行光合作用时,突然停止光照,C3的含量__________(填“升高”或“降低”或“不变”)。若用H![]() O培养该植物,发现叶肉细胞中出现了(CH
O培养该植物,发现叶肉细胞中出现了(CH![]() O),分析其最可能的转化途径是:_______________________(用相关物质、过程和箭头表示)。
O),分析其最可能的转化途径是:_______________________(用相关物质、过程和箭头表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A. 当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
B. 人体吸入的CO越多,与血红蛋白结合的O2越少
C. CO与HbO2反应的平衡常数K=![]()
D. 把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1) CH2=CHCH=CH2的系统命名为______________;
(2)3—甲基—2一戊烯的结构简式为______________;
(3)![]() 的分子式为______________;
的分子式为______________;
(4)某烃的分子式为C4H4,它是合成橡胶的中间体,它有多种同分异构体
①试写出它的一种链式结构的同分异构体的结构简式______________.
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为______________形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生兴趣小组模拟工业制取无水Na2SO3的过程如下:

已知:①反应Ⅰ在三颈烧瓶中发生,装置如图所示(固定及加热类仪器省略);
②H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图;
③Na2SO3·7H2O 和Na2SO3的溶解度曲线如图。
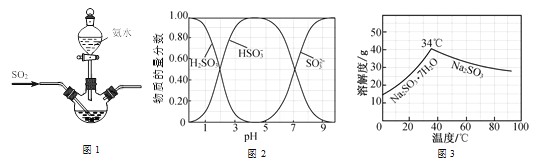
(1)为提高Na2SO3产率,反应Ⅰ应控制pH在_____左右。
(2)反应Ⅱ所得滤液的主要成分是_____和Na2SO3。
(3)将操作Ⅰ后所得的Na2SO3溶液_____(填操作),过滤出的固体用无水乙醇洗涤、在真空干燥箱中采用150℃干燥,得无水Na2SO3固体。
(4)可以用KIO3测定产品中无水Na2SO3的纯度:称取0.1260 g样品于锥形瓶中,用蒸馏水溶解,并加入淀粉做指示剂,滴加酸性KIO3溶液(a mol·L-1)至Na2SO3恰好完全氧化成Na2SO4,发生反应3Na2SO3 + KIO3 = 3Na2SO4 + KI,消耗KIO3溶液体积为b mL。通过计算确定样品中Na2SO3的质量分数(写出计算过程)____
(5)滴加酸性KIO3溶液时,剧烈震荡锥形瓶或者滴加时间过长都会造成所测Na2SO3纯度偏低,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 == 2NaNO2 + CO2;2NO2 + Na2CO3 == NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3![]() N2 + H2O
N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列说法正确的是
A. 混合气体中V(N2O4) = 0.336 L
B. 混合气体中n(NO)∶n(NO2) = 1∶5
C. NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5
D. 如采用氨的催化氧化法处理,理论消耗n(NH3) = ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2![]() +8H2O,下列说法正确的是 ( )
+8H2O,下列说法正确的是 ( )
A.氧化产物与还原产物的物质的量之比为2:5
B.每生成1molCl2时转移2mol e-
C.KMnO4的还原性强于Cl2的还原性
D.参与反应的氧化剂与还原剂的物质的量之比为1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取ag样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和________(填字母)。
(2)步骤②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL,量取该体积的浓H2SO4用到量筒规格是________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式![]() Fe2++
Fe2++![]() ClO2+
ClO2+![]()
![]() ===
===![]() Fe3++
Fe3++![]() Cl-+
Cl-+![]() H2O__________________,从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
H2O__________________,从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)第⑥步的操作中,将沉淀物转移到________(填仪器名称)中加热,冷却到室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是________________。
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”);若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为________(列出算式,不需化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com