
【题目】如图为某植物叶绿体结构和功能的示意图。请分析回答问题:
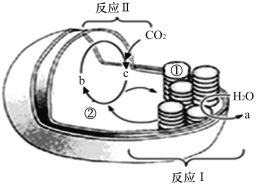
(1)物质a是____________,物质b是________________。
(2)光合作用的光反应阶段发生在_______(填“Ⅰ”或“Ⅱ”),该反应将光能转变为__________________。
(3)叶绿体增加膜面积的方式是____________________________________。在适宜光照和温度条件下培养,由①处转移至②处的物质主要是_____________________。
(4)该植物进行光合作用时,突然停止光照,C3的含量__________(填“升高”或“降低”或“不变”)。若用H![]() O培养该植物,发现叶肉细胞中出现了(CH
O培养该植物,发现叶肉细胞中出现了(CH![]() O),分析其最可能的转化途径是:_______________________(用相关物质、过程和箭头表示)。
O),分析其最可能的转化途径是:_______________________(用相关物质、过程和箭头表示)。
【答案】O2 C5 Ⅰ ATP中(活跃)的化学能 类囊体堆叠成基粒 ATP、[H] 升高 H218O→C18O2→(CH218O)
【解析】
光合作用分为两个阶段进行,在这两个阶段中,第一阶段是直接需要光的称为光反应,第二阶段不需要光直接参加,是二氧化碳转变为糖的反过程称为暗反应。光合作用在叶绿体中进行,光反应的场所位于类囊体膜,暗反应的场所在叶绿体基质。光反应的发生需要叶绿体类囊体膜上的色素、酶参与。图中a为O2,b为C5,c为C3。反应I为光反应,反应II为暗反应。
(1)物质a是水光解得到的,是氧气(O2)。物质b是用来固定CO2的,是C5。
(2)光合作用的光反应阶段发生在I,在类囊体膜上进行。光反应将光能转变为ATP中(活跃)的化学能。
(3)类囊体堆叠成基粒使得叶绿体膜面积大大增加。在适宜光照和温度条件下培养,由①进行光反应,可以为②暗反应提供ATP、[H]。
(4)C3的还原需要光反应为其提供能量和还原剂,突然停止光照,C3的还原减慢,因此C3的含量升高。若用H![]() O培养该植物,H
O培养该植物,H![]() O参与有氧呼吸的第二阶段,产生C18O2,C18O2参与光合作用的暗反应,转化为(CH218O)。
O参与有氧呼吸的第二阶段,产生C18O2,C18O2参与光合作用的暗反应,转化为(CH218O)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将浓度都是0.1mol·L-1的X2、Y2两种气体充入至密闭容器中,使之发生反应生成气体Z,达到平衡时c(X2)=0.04mol·L-1、c(Y2)=0.08mol·L-1、c(Z)=0.04mol·L-1,则该反应的反应式是
A. X2+2Y2![]() XY2 B. 3X2+Y2
XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. 2X2+Y2![]() 2X2Y D. X2+3Y2
2X2Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。下列分析不正确的是( )

A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
(1)写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(2)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______________________。
(3)欲用2LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp (BaCO3)=1×10-10]。(忽略溶液体积的变化)
(二)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。
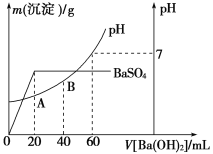
计算:(1)原混合溶液中c(Cl-)=________。
(2)A点的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是

A. a点时溶液中所含主要溶质为(NH4)2SO4
B. a→b段发生反应的离子方程式是 SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. b点为最大沉淀量,对应的纵坐标值为0.02
D. c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷催化裂化时碳链按两种方式断裂,生成两种烷烃和两种烯烃。如果丁烷的裂化率为60%,且裂化生成的两种烯烃物质的量相等,则裂化后得到的含氢质量分数最高的气体占混合气体的体积分数为
A. 18.75% B. 30% C. 15% D. 22.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。

(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐的形式存在,可用电解法从溶液中除去。有Cl-存在时。除氮原理如图1所示。主要依靠有效氯(HClO、ClO-)将NH4+或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度与溶液pH的关系如图2所示。
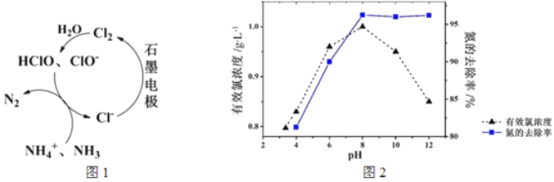
下列说法不正确的是
A. pH=3时,主要发生ClO-氧化NH3的反应
B. pH>8时,有效氯浓度随pH的增大而减小
C. pH>8时,NH4+转变为NH3·H2O,且有利于NH3逸出
D. pH<8时,氮的去除率随pH的减少而下降的原因是c(HClO)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是
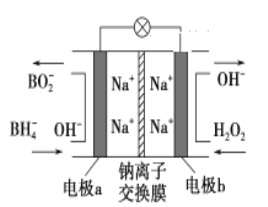
A. 电池工作时Na+从b极区移向a极区
B. a极上的电极反应式为:BH4-+8OH--8e-===BO2-+6H2O
C. 每消耗3 mol H2O2,转移3 mol e-
D. b极上的电极反应式为:H2O2+2e-+2H+===2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com