
 ,元素离子电子层数越多,半径越大,核外电子排布相同的离子,原子序数越小,离子半径越大,故O、Al、S的离子半径由大到小的顺序为:S2->O2->Al3+,故答案为:
,元素离子电子层数越多,半径越大,核外电子排布相同的离子,原子序数越小,离子半径越大,故O、Al、S的离子半径由大到小的顺序为:S2->O2->Al3+,故答案为: ;S2->O2->Al3+;
;S2->O2->Al3+;
| ||
| ||
| 3 |
| ||
| 10-14 |
| 10-10 |


科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算 查看答案和解析>>
科目:高中化学 来源: 题型:
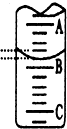 我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第三周期第IA族 |
| B、第四周期第IA族 |
| C、第三周期第ⅡA族 |
| D、第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 碳酸钠溶液 | 分液 |
| D | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
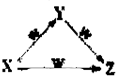 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )| A、①②③④ | B、①②④ |
| C、③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、400mL1mol/L 盐酸 |
| B、200mL 2.5mol/L MgCl2溶液 |
| C、300mL 2mol/L AlCl3溶液 |
| D、100mL 3mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | 溶液 | ||
| 2 | 20 | 溶液 | ||
| 3 | 20 | |||
| 4 | 20 | 无 | ||
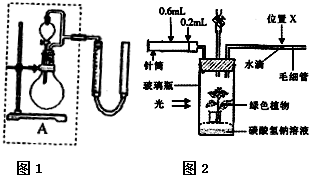 实验1、2研究的目的是
实验1、2研究的目的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com