
| A、第三周期第IA族 |
| B、第四周期第IA族 |
| C、第三周期第ⅡA族 |
| D、第四周期第ⅡA族 |
| 1.12L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、M2Z2、W2Z2均为含非极性键的共价化合物 |
| C、由X元素形成的单质有的可以导电 |
| D、由X、Y、Z、M四种元素形成的化合物中不可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
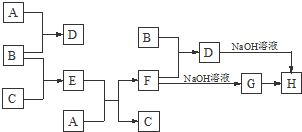
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
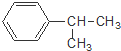 的叙述中,不正确的是( )
的叙述中,不正确的是( )| A、它难溶于水,但易溶于苯. |
| B、它会使酸性高锰酸钾溶液褪色 |
| C、与Br2发生取代反应可生成三种一溴代物 |
| D、一定温度下可以和浓硝酸、浓硫酸的混合物发生硝化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
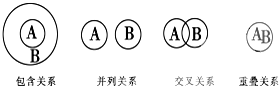
| A、化合物与电解质属于包含关系 |
| B、单质与非电解质属于包含关系 |
| C、溶液与分散系属于并列关系 |
| D、化合物与碱性氧化物属于交叉关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应的△H 由生成物与反应物的焓值差决定 |
| B、反应在恒压条件下的热效应为焓变 |
| C、某些反应的△H 可以通过实验测得 |
| D、放热反应的焓变取正值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com