
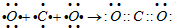 ,
,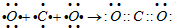 ;
;| 1 |
| 1+20% |
| 1 |
| 1-a+a+a |
| △c |
| △t |
| ||
| 2min |
| m |
| V |
| 0.2mol |
| 1mol |
| m |
| n |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
| A、0.15 mol?L-1 |
| B、0.3 mol?L-1 |
| C、0.225 mol?L-1 |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
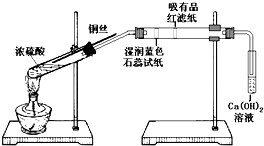 某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )
某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )| A、湿润的蓝色石蕊试纸先变红后褪色 |
| B、左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C、从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D、本实验体现出了二氧化硫的酸性、漂白性和弱氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
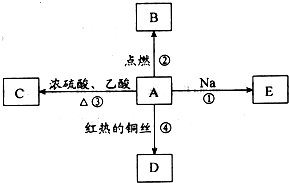 ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、D元素处于元素周期表中第3周期第Ⅳ族 |
| B、B与D形成的化合物中,每个原子的最外层电子均为8个电子 |
| C、B、D的最高价氧化物中,D的最高价氧化物熔沸点高的根本原因在于D的最高价氧化物相对分子质量比B的最高价氧化物高 |
| D、A与D形成的化合物是一种稳定性较差的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
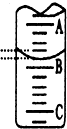 我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下: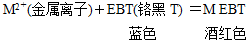
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第三周期第IA族 |
| B、第四周期第IA族 |
| C、第三周期第ⅡA族 |
| D、第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用渗析法鉴别Fe(OH)3胶体和FeCl3溶液,用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液 |
| B、Fe(OH)3胶体微粒带负电荷,在通电的情况下胶体微粒向直流电源的正极移动,这种现象称为电泳 |
| C、向沸腾的蒸馏水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时即得到Fe(OH)3胶体 |
| D、向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅拌,然后继续煮沸制备Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com