
| ||
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | 溶液 | ||
| 2 | 20 | 溶液 | ||
| 3 | 20 | |||
| 4 | 20 | 无 | ||
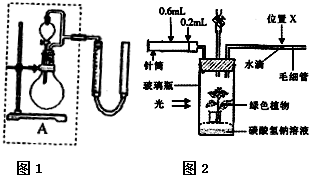 实验1、2研究的目的是
实验1、2研究的目的是| 0.448L |
| 22.4L/mol |
| 0.05mol×78g/mol |
| 4g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v (NO)=0.02 mol?(L?s)-1 |
| B、v (NO)=0.2mol?(L?s)-1 |
| C、v (NH3)=0.01 mol?(L?s)-1 |
| D、v (NH3)=0.1 mol?(L?s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应的△H 由生成物与反应物的焓值差决定 |
| B、反应在恒压条件下的热效应为焓变 |
| C、某些反应的△H 可以通过实验测得 |
| D、放热反应的焓变取正值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤⑦⑧ | B、①②⑥⑦ |
| C、②③⑦⑧ | D、③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
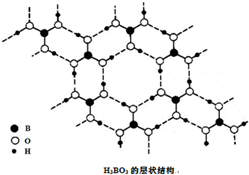 正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )| A、正硼酸晶体中只存在氢键 |
| B、H3BO3分子的稳定性与氢键有关 |
| C、分子中硼原子最外层为8电子稳定结构 |
| D、含1molH3BO3的晶体中有3mol氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液[Ba(OH)2]:用Na2SO4溶液 |
| B、CuO粉末[Fe粉]:用稀盐酸 |
| C、Mg粉[Al粉]:用NaOH溶液 |
| D、HNO3溶液[HCl]:用AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠只有在加热条件下才能与氯气反应 |
| B、钠与氧气反应的产物与反应条件有关 |
| C、工业上通过电解熔融NaCl制备金属钠 |
| D、实验室常将钠保存在煤油中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com