
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算 | m |
| M |
| n |
| v |
| n |
| c |
| n |
| c |
| m |
| M |
| 24g |
| 40g/mol |
| n |
| v |
| 0.6mol |
| 0.5L |
| n |
| c |
| 1.2mol/L×0.01L |
| 0.1mol/L |
| n |
| c |
| 0.002mol |
| 0.1mol/L |


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| 离子 | Na+ | Al3+ | Cl- | X |
| 个数 | 3a | 2a | a | b |
| A、SO42-、4 a |
| B、NO3-、4 a |
| C、OH-、8 a |
| D、SO42-、8 a |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、M2Z2、W2Z2均为含非极性键的共价化合物 |
| C、由X元素形成的单质有的可以导电 |
| D、由X、Y、Z、M四种元素形成的化合物中不可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
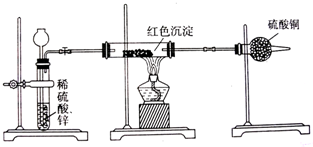
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X、Y处于同一周期,则化合物M不可能是正四面体型分子晶体 |
| B、若X的单质常温下是气体,则Y的单质常温下也是气体 |
| C、若X、Y两元素周期数差1,则属于离子化合物的M只有四种 |
| D、若M属于离子晶体,则其中可能含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | E的氧化物是生活中最常见的液体,D、E同族 |
| F | A与B、F相邻,且A、B、E、F四种元素组成一种离子化合物丙,1mol丙含有10mol原子 |
| G | G、D同周期,G是所在周期元素非金属性最强的 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com