
| A、若X、Y处于同一周期,则化合物M不可能是正四面体型分子晶体 |
| B、若X的单质常温下是气体,则Y的单质常温下也是气体 |
| C、若X、Y两元素周期数差1,则属于离子化合物的M只有四种 |
| D、若M属于离子晶体,则其中可能含有非极性键 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| A、X的最高价氧化物的水化物的碱性比Y的最高价氧化物的水化物的碱性强 |
| B、X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C、与H2化合时X单质不如Y单质容易 |
| D、Y单质可以X把从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏水、氨水、氢氧化钡、二氧化硫 |
| B、纯盐酸、空气、硫酸、干冰 |
| C、胆矾、盐酸、铁、碳酸钙 |
| D、氧化钙、漂白粉、氧化铝、碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算 查看答案和解析>>
科目:高中化学 来源: 题型:
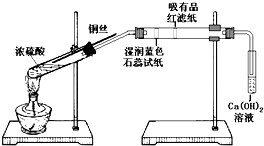 某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )
某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )| A、湿润的蓝色石蕊试纸先变红后褪色 |
| B、左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C、从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D、本实验体现出了二氧化硫的酸性、漂白性和弱氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
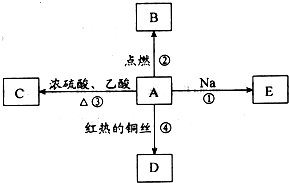 ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.查看答案和解析>>
科目:高中化学 来源: 题型:
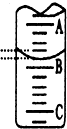 我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
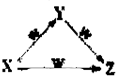 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )| A、①②③④ | B、①②④ |
| C、③④ | D、①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com