
【题目】最近一个科学硏究小组创建了一种通过连续电解将能量储存为化学能的装置。在氧化钇基质的阳极和二氧化钛涂覆的钛阴极之间是可通过H+的固体聚合物电解质。其结构如图所示,则下列说法正确的是
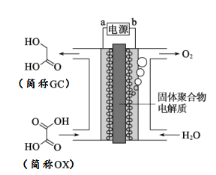
A. 电源的b极为负极
B. 在能量转换过程中,固体电解质中H+由阴极向阳极移动
C. 阴极电极反应式为:OX + 4H+ + 4e﹣═ GC + H2O
D. 为增强阳极电解液导电性,可在水中添加适量NaCl
【答案】C
【解析】
该装置为电解池,由结构示意图可知,与电源b相连的电极上水失电子发生氧化反应生成氧气,则b极为电源的正极,a极为电源的负极,与电源a相连的电极上OX得电子发生还原反应生成GC,电极反应式为OX + 4H+ + 4e﹣═ GC + H2O。
A项、与电源b相连的电极上水失电子发生氧化反应生成氧气,则b极为电源的正极,故A错误;
B项、电解过程中,阳离子由阳极向阴极移动,则在能量转换过程中,固体电解质中H+由阳极向阴极移动,故B错误;
C项、b极为电源的正极,a极为电源的负极,与电源a相连的电极上OX得电子发生还原反应生成GC,电极反应式为OX + 4H+ + 4e﹣═ GC + H2O,故C正确;
D项、该电解池选用的是固体聚合物电解质,不是电解质溶液,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol ,则CH4(g) +![]() O2(g) = CH3OH(g) △H=___。
O2(g) = CH3OH(g) △H=___。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) △H<0。
CH3OCH3(g) + H2O(g) △H<0。
①.某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是___。
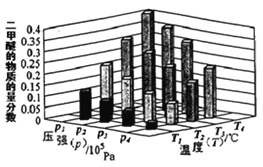
A. P1>P3, T1>T3 B. P3>P2,T3>T2 C.P2>P4,T4>T2 D.P1>P4,T2>T3
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.某反应物的体积百分含量增大
(3)在一容积可变的密闭容器中充有10 mol CO和20 mol H2, 发生反应CO(g)+2H2(g) ![]() CH3OH(g),CO的平衡转化率[与温度(T)、压强(p)的关系如图所示。
CH3OH(g),CO的平衡转化率[与温度(T)、压强(p)的关系如图所示。

①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
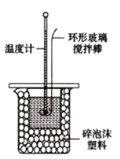
【题目】实验室用50mL 0.50mol/L盐酸、50mL0.55mol/L NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度/℃ | 终止温度/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___。实验中使用环形玻璃搅拌棒的操作方法是____;
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____;
(3)根据表中所测数据进行计算,则该实验测得的中和热![]() =_____ [盐酸和NaOH溶液的密度按1
=_____ [盐酸和NaOH溶液的密度按1![]() 计算,反应后混合溶液的比热容(c)按4.18
计算,反应后混合溶液的比热容(c)按4.18![]() 计算]。如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的中和热将______ (填“偏大”“偏小”或“不变”)。
计算]。如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的中和热将______ (填“偏大”“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热数值偏低,请你分析可能的原因是__________;
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C.做本实验的当天室温较高 D.在量取盐酸时仰视读数 E.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(Ⅰ)(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)
(Ⅱ)N2O4(g)2NO2(g)
(1)反应(Ⅰ)中氧化剂是___。
(2)当温度升高时,气体颜色变深,则反应(Ⅱ)为___(填“吸热”或“放热”)反应。
(3)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=_______molL-1s-1。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___(用离子方程式表示)。
(5)向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是有重要用途的一元弱酸。请回答下列问题:
(1)单质硼溶于热的浓硝酸可以生成硼酸,该反应的化学方程式为___________。
(2)利用铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)制硼酸,已知天然的Fe3O4不溶于酸。生产硼酸的工艺流程如下:
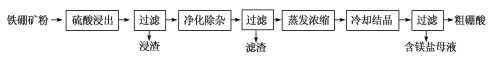
①“浸渣”主要成分的化学式为_____________。
②“净化除杂”:滤液保持一定温度,需先加H2O2溶液,然后再调节溶液的pH=5.6。温度不宜过高的原因是___________。调节溶液的pH=5.6的主要目的是___________。
[已知:Ksp[Fe(OH)3]=2.6×10-39], Ksp[Al(OH)3]=1.3×10-33,
[已知:Ksp[Fe(OH)2]=4.7×10-6], Ksp[Mg(OH)2]=5.6×10-12,
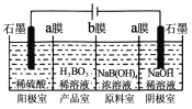
(3)硼酸也可以通过电解方法制备。工作原理如图所示。
①写出阳极的电极反应式___________________。
②a膜或b膜为阳离子交换膜的是________;阴极室溶液的浓度________(填“变大”、“不变”、“变小”)。
(4)写出一定条件下硼酸与氢氧化钠溶液反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)据报道,我国在南海进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是___(填“低温”或“高温”),ΔH3=__kJ·mol-1。
(2)根据部分键能数据,以及热化学方程式CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1940kJ·mol-1,计算H—F键的键能为__kJ·mol-1。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | ? | 155 |
(3)0.1mol的氯气和焦炭、TiO2固体完全反应,生成TiCl4液体和CO气体,放出热量4.28kJ,写出该反应的热化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) / mol | 0 | 0.16 | 0.19 | 0. 20 | 0.20 |
下列说法正确的是( )
A. 反应在前2 s 的平均速率v(CO)=0.080mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Cl2) =0.11mol·L-1,则反应的ΔH<0
C. T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,达到平衡前v正>v逆
D. T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com