
����Ŀ��ȼú���ŷŴ�����CO��CO2��SO2��PM2.5(����ο�����)��ȾҲ������ȼú������ء�SO2��CO��CO2Ҳ�ǶԻ���Ӱ��ϴ�����壬�����ǵĺ������ơ��������Ż��������滷������Ч;����
��1����CH4����ԭ��������������������������Ⱦ��
��֪��CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g)��Ӧ���������仯��ͼ��ʾ��
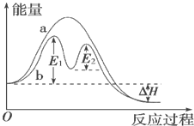
����˵����ȷ����_____��
A����Ӧ����a�д�������
B���÷�ӦΪ���ȷ�Ӧ����ЧӦ���ڦ�H
C���ı�������ܸı�÷�Ӧ�Ļ�ܺͷ�Ӧ��
D���д��������£���Ӧ�Ļ�ܵ���E1
��2����֪��CH3OH��H2��ȼ���ȣ���H���ֱ�Ϊ��726.5kJ/mol����285.8kJ/mol��������CO2��H2��Ӧ����CH3OH��H2O���Ȼ�ѧ����ʽ�� ��
��3����ҵ�ϻ�����ͨ�����з�Ӧ�Ʊ��״���CO(g)��2H2(g)![]() CH3OH(g)����һ�ݻ��ɱ���ܱ����� �г���10mol CO��20mol H2��CO��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ��
CH3OH(g)����һ�ݻ��ɱ���ܱ����� �г���10mol CO��20mol H2��CO��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ��

������˵�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_________������ĸ����
a��H2���������ʵ���CH3OH���������ʵ�2��
b��H2������������ٸı�
c����ϵ��H2��ת���ʺ�CO��ת�������
d����ϵ�������ƽ��Ħ���������ٸı�
���Ƚ�A��B����ѹǿ��СPA__________PB�����������=������
�����ﵽ��ѧƽ��״̬Aʱ�����������Ϊ20L�������Ӧ��ʼʱ�Գ���10molCO��20molH2������ƽ��״̬Bʱ���������V��B����__________L��
��4��SO2��һ�������¿�����������ԭ��ء���ͼ�����øõ���������������װ��ʾ��ͼ��

���õ�صĸ�����Ӧʽ�� ��
�����������ı����1.12L����ʱ������ ������a��b������_________g��
���𰸡�
��1��BD��2�֣�
��2��CO2��g��+3H2��g��=CH3OH��l��+H2O��l�� ��H=��130.9 kJ/mol��2�֣�
��3����ac��2�֣�
������2�֣�
��4��2�֣�
��4���� SO2��2e��+2H2O��4H����SO42-��2�֣�
��b (1��) 21.6��2�֣�
��������
���������
��1��A��b��ʹ���˴�����A����B����Ӧ�����������������ӦΪ���ȷ�Ӧ����H=����������-��Ӧ����������ЧӦ������H��B��ȷ��C����ͬ�Ĵ�������Ӧ�Ļ�ܲ�ͬ���ı�������ܸı�÷�Ӧ�Ļ�ܣ�����Ӧ�Ȳ��䣬C����D��E1��E2�ֱ������Ӧ�����и�����Ӧ�Ļ�ܣ�������Ӧ�Ļ��Ϊ�����ϸߵ�E1��D��ȷ����ѡBD��
��2����֪CH3OH��H2��ȼ���ȣ���H���ֱ�Ϊ��726.5kJ/mol����285.8kJ/mol��
����CH3OH��l��+3/2O2��g��=CO2��g��+2H2O(l����H=��726.5 kJ/mol��
��H2��g��+1/2O2��g��=H2O(l����H=��285.8kJ/mol��
���ݸ�˹���ɣ�����3-�����ɵõ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l�� ��H=��130.9 kJ/mol��
��3����a���������������ʵ���CH3OH���������ʵ�2��������˵�����淴Ӧ������ȣ���һ��ƽ�⣬a����b������������������ٸı��ǻ�ѧƽ����������ﵽ��ƽ�⣬b��ȷ��c����ϵ��������ת���ʺ�CO��ת������ȣ�����˵�����淴Ӧ������ȣ���һ��ƽ�⣬c����d����ϵ�������ƽ��Ħ�������������������ʵ����ı�ֵ�����ʵ����仯���������䣬���Ե���ϵ�������ƽ��Ħ���������ٸı䣬֤���ﵽ��ƽ�⣬d��ȷ����ѡac��
������Ӧ����Ϊ���������С�ķ���T1��ʱ�Ƚ�CO��ת���ʣ�ת����Խ����ѹǿԽ��ͼ����PBת���ʴ���PA����֪PA��PB��
������A��ɵ�ƽ�ⳣ��K��![]() ���¶Ȳ��䣬ƽ�ⳣ�����䡣A��B�������¶���ͬ������ѧƽ�ⳣ����ȣ���B��ʱCO��ת����Ϊ0.8����
���¶Ȳ��䣬ƽ�ⳣ�����䡣A��B�������¶���ͬ������ѧƽ�ⳣ����ȣ���B��ʱCO��ת����Ϊ0.8����
CO��g��+2H2��g��![]() CH3OH��g��
CH3OH��g��
��ʼ��mol����10 20 0
ת����mol����8 16 8
ƽ�⣨mol����2 4 8
�����ΪVL������K=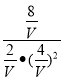 ��4
��4
���V=4L��
��4����SO2�ڸ�����ʧȥ���ӣ���Ϊ�������Һ�к���H+����缫����ʽΪ��SO2��2e��+2H2O��4H����SO42����
�������������������ʵ�����1.12L��22.4L/mol��0.05 mol��ת�Ƶ�����0.05mol��4��0.2mol�������������������õ�����ת��Ϊ�������Դ��������������������������b�����أ����ӵ�������0.2mol��108g/mol��21.6g��


 Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д� ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�飮��ش�������⣺


���Է�������1����ͼ����ʾ��ͨ���۲�____________________�����ԱȽϵó����ۣ�
��2����ͬѧ����Լ���ѡ���ף�Ӧ��FeCl3��Ϊ��Ϊ_____________������
��3��H2O2�ڶ������������·����ķ�Ӧ�ɷ�Ϊ��������һ���ķ���ʽΪ��2MnO2+H2O2=2HMnO3���ڶ����Ļ�ѧ����ʽΪ��___________________________������һ����Ӧ���ڶ�����Ӧ�죬���ܷ�Ӧ������_____________�����һ������ �ڶ�������������
������������4����ͼ����ʾ����ʵ��ʱ������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�ʵ������Ҫ�����������ǣ�_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�в������зḻ�ķǽ���Ԫ����Դ(��Cl��Br��I��)�������зḻ�Ľ���Ԫ����Դ(��Na��Mg��Fe��Cr��)��
(1)��ˮɹ�ε�ԭ����________��д���Ȼ��Ƶĵ���ʽ��________________����Na��Clͬ���ڣ��Ҽ����Ӱ뾶��С�����ӽṹʾ��ͼ��______________��
(2)ɹ���Ĵ��γ�����MgSO4��CaSO4�����ʣ�Ϊ�˵õ������Σ����ᴿ���̲�������ͼ����Լ���˳���ǣ����ܽ⣬��________���ۼӹ���Na2CO3��Һ����________���ݹ��˳�ȥ���ʣ���________���������ᾧ��
(3)ɹ�εõ���ĸҺ(��±)�к��зḻ��þԪ�أ������г�����Fe2����Cr3���ȣ�Ϊ����þʹ��ת��ΪMgCl2���塣
�й����ϣ�
M(OH)n | pH | |
������ȫ | ��ʼ���� | |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Mg(OH)2 | 9.5 | 11.0 |
Cr(OH)3 | 4.3 | 5.0 |
Ϊ����Ч��ȥ�������ӣ��ֲ������µ��������ӣ��������㡰��ɫ��ѧ�����������Լ�ѡ��Ͳ����ǣ�
���ȼ�________��Ŀ����_______________________________��
���ټ�________��Ŀ����_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ں���0.1mol/L CO32- ����Һ���ܴ����������
A. H+ B. Ca2+ C. K+ D. Ba2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʽΪC2H6O�Ļ�����A�����������ʣ�
A+Na��������������
A+CH3COOH![]() ����ζ�IJ���
����ζ�IJ���
��1������������Ϣ���Ըû�������������ж��� ______ ��
A��һ������-OH B��һ������-COOH C��AΪ�Ҵ� D��AΪ��ȩ
��2����A���������Ϊ75%��ˮ��Һ�������� ______ ��
��3��A���Ʒ�Ӧ�Ļ�ѧ����ʽ�� ________________________________________ ��
��4��������A��CH3COOH��Ӧ���ɵ�����ζ�IJ���Ľṹ��ʽΪ��________________ ��
��5��д��A�����ڴ������������¼��Ⱥ�������Ӧ�Ļ�ѧ����ʽ��___________________��
��6����ͼ��B���ӵ����ģ�ͺ�A���ӵı���ģ�ͣ���A��B�Ĺ�ϵ��ͬϵ���B�Ľṹ��ʽ ______ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������Ҵ������������������ȼ�գ��õ�һ����̼��������̼��ˮ��������Ϊ27.6g������ˮ������Ϊ10.8g������һ����̼�Ͷ�����̼��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ���ϻ�ѧʵ�鰲ȫҪ�����
A. ��ʵ��ʣ��Ľ�����ֱ�Ӷ����ڷ�Һ����
B. ����ϡ����ʱ����ˮ��������Ũ�����в����Ͻ���
C. ��ȼCH4ǰ����������Ĵ���
D. ��������й©ʱ��Ѹ���뿪�ֳ����������ʹ�ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E ��Ϊ������Ԫ�أ�A �����ԭ��������С��Ԫ�أ�B �ģ�1 �������Ӻ� C �ġ�1 �������Ӷ�����ԭ�Ӿ�����ͬ�ĵ��Ӳ�ṹ��D �� C ����һ���ڣ����� B �γ� BD �����ӻ����E �� C Ϊͬһ����Ԫ�أ�������������Ӧ��ˮ����Ϊһ��ǿ�ᡣ�����������Ϣ�ش��������⡣
��1��B Ԫ����Ԫ�����ڱ��е�λ���ǵ�______����______�塣
��2������ D Ԫ�ص�ԭ�ӽṹʾ��ͼ____________��
��3���� E ���⻯�������������������ȵķ����� ____________(��һ�����ѧʽ����ͬ )��������____________��
��4��A �� C �γɵĻ������к��л�ѧ����������____________��
��5��D�ĵ�����B������������Ӧ��ˮ�������Һ������Ӧ�����ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com