
����Ŀ����ˮ�в������зḻ�ķǽ���Ԫ����Դ(��Cl��Br��I��)�������зḻ�Ľ���Ԫ����Դ(��Na��Mg��Fe��Cr��)��
(1)��ˮɹ�ε�ԭ����________��д���Ȼ��Ƶĵ���ʽ��________________����Na��Clͬ���ڣ��Ҽ����Ӱ뾶��С�����ӽṹʾ��ͼ��______________��
(2)ɹ���Ĵ��γ�����MgSO4��CaSO4�����ʣ�Ϊ�˵õ������Σ����ᴿ���̲�������ͼ����Լ���˳���ǣ����ܽ⣬��________���ۼӹ���Na2CO3��Һ����________���ݹ��˳�ȥ���ʣ���________���������ᾧ��
(3)ɹ�εõ���ĸҺ(��±)�к��зḻ��þԪ�أ������г�����Fe2����Cr3���ȣ�Ϊ����þʹ��ת��ΪMgCl2���塣
�й����ϣ�
M(OH)n | pH | |
������ȫ | ��ʼ���� | |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Mg(OH)2 | 9.5 | 11.0 |
Cr(OH)3 | 4.3 | 5.0 |
Ϊ����Ч��ȥ�������ӣ��ֲ������µ��������ӣ��������㡰��ɫ��ѧ�����������Լ�ѡ��Ͳ����ǣ�
���ȼ�________��Ŀ����_______________________________��
���ټ�________��Ŀ����_______________________________��
���𰸡� �����ᾧ ![]()
![]() �ӹ���BaCl2��Һ �ӹ���NaOH ��ϡHCl����Һ������ H2O2 ��Fe2��������Fe3�� MgO ������ҺpH��5.0<pH<9.5��ʹ����������ȫ����
�ӹ���BaCl2��Һ �ӹ���NaOH ��ϡHCl����Һ������ H2O2 ��Fe2��������Fe3�� MgO ������ҺpH��5.0<pH<9.5��ʹ����������ȫ����
��������(1)������ˮ�ﵽ���ͣ��ټ��������������Ȼ����ܽ�����¶ȱ仯�����ɵõ����Σ���ͨ�������ᾧ�����õ��Ȼ��ƾ��壻�Ȼ��Ƶ���ʽΪ��![]() ����Na��Clͬ���ڣ��Ҽ����Ӱ뾶��С������ΪAl3+�����ӽṹʾ��ͼΪ��
����Na��Clͬ���ڣ��Ҽ����Ӱ뾶��С������ΪAl3+�����ӽṹʾ��ͼΪ��![]() ��
��
(2)Ҫ��ȥ�����к��еĿ��������ʣ��ټ�������Լ���ʱ��̼���Ʊ�������Ȼ����ĺ��棬�Ա�֤�������ı����ӳ������ڼӹ����Ȼ�����Һ���ܼӹ�������������Һ����ϡ��������Һ�������ԣ�
(3)����ͼ�������ж�PH�ﵽ5ʱ�������ӡ�������ȫ��������ȫ�����������ӳ�����ȫ��PHΪ9.6����ʱþ����Ҳ�������ﲻ������þ��Ŀ�ģ�������Ҫ�����������Ѷ�������������Ϊ���������ӣ�������ҺPH=5������ʹ�������ӳ�ȥ����Ч��ȥ�������ӣ��ֲ������µ��������ӣ�������������ɫ��ѧ��������
��������Լ�Ӧ�ǹ���������������������ԭΪˮ��
���ټ�������þ������ҺPH��5-9.5������ʵ���������ӳ������������µ����ʣ�������ɫ��ѧ������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���������������ȣ��� �� ��
A. ����ԭ����һ�����B. ���ʵ���һ����ͬC. ����һ����ͬD. �ܶ�һ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������й��˺�����������Ҫ�õ���������
A. ������ B. �ձ� C. ������ƿ D. �ƾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����ˮ��Һ������״̬���ܹ�����Ļ���������������ڵ���ʵ���
A. Cl2 B. NaOH C. C2H5OH D. NaCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��ʾ������һ���Ǵ��������( )
A. C5H10B. C4H8C. CH2Cl2D. C2H4Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������һ������Ư�������������㷺Ӧ����ũҵ��ҽҩ�����û������������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ�������������Ӧ�ķ���ʽΪ��
CO(NH2)2+H2O2![]() CO(NH2)2��H2O2�����������صIJ����������£�
CO(NH2)2��H2O2�����������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص����̼���Ӧװ��ͼ��ͼ��


��ش��������⣺
��1������X��������__________������������ȴˮ��____���a����b�����ڳ�����
��2���÷�Ӧ���¶ȿ���30������ܹ��ߵ�ԭ����_______________________��
��3���������˲��õIJ�����_____________��
A���������� B����ѹ���� C����ѹ����
��4����ʵ�����Ƶ������þ��壬���˺���Ҫ����ˮϴ�ӣ������ϴ�Ӳ�����_________________��
��5��ȷ��ȡ1.000g��Ʒ��250mL��ƿ�У�����������ˮ�ܽ⣬�ټ�2mL6mol��L��1H2SO4����0.2000mol��L��1KMnO4����Һ�ζ����յ�ʱ����18.00mL��������KMnO4��Һ����Ӧ�������Ʒ��CO(NH2)2��H2O2����������Ϊ_____________�����ζ����Ӷ��������õĹ��������غ���________���ƫ�ߡ�����ƫ�͡����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��һ�������£���1.00molN2(g)��3.00molH2(g)�����һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3(g)��ƽ��Ũ����ͼ��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��

(1)���¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1___________K2(��������������������=��)���ʱ���H___________0��(����������������)
(2)�÷�Ӧ��T1�¶���5.0min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ___________,N2��ת����___________��
(3)T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1=___________��
(4)T1�¶�ʱ������ø�¯��c(N2)=0.5mol/L��c(H2)=0.5mol/L��c(NH3)=0.5mol/L����������£��÷�Ӧ�Ƿ���ƽ��״̬___________(���ǻ��)����ʱ��Ӧ������v��___________v��(�������=)��
��.���������о��������ڳ��³�ѹ����������N2�ڴ���������ˮ������Ӧ��2N2(g)+6H2O(l)��4NH3(g)+3O2(g)��
(1)�˷�Ӧ����S 0(����������������)��
��֪2CO(g)+2NO(g)=N2(g)+2CO2(g) ��H="-a" kJ��mol-1
2NO(g)+O2(g)=2NO2(g) ��H ="-b" kJ��mol-1��CO��ȼ������H ="-c" kJ��mol-1��
(2)д����������β����NO2����Ⱦʱ��NO2��CO�ķ�Ӧ���Ȼ�ѧ��Ӧ����ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú���ŷŴ�����CO��CO2��SO2��PM2.5(����ο�����)��ȾҲ������ȼú������ء�SO2��CO��CO2Ҳ�ǶԻ���Ӱ��ϴ�����壬�����ǵĺ������ơ��������Ż��������滷������Ч;����
��1����CH4����ԭ��������������������������Ⱦ��
��֪��CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g)��Ӧ���������仯��ͼ��ʾ��
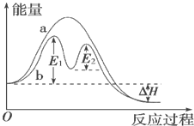
����˵����ȷ����_____��
A����Ӧ����a�д�������
B���÷�ӦΪ���ȷ�Ӧ����ЧӦ���ڦ�H
C���ı�������ܸı�÷�Ӧ�Ļ�ܺͷ�Ӧ��
D���д��������£���Ӧ�Ļ�ܵ���E1
��2����֪��CH3OH��H2��ȼ���ȣ���H���ֱ�Ϊ��726.5kJ/mol����285.8kJ/mol��������CO2��H2��Ӧ����CH3OH��H2O���Ȼ�ѧ����ʽ�� ��
��3����ҵ�ϻ�����ͨ�����з�Ӧ�Ʊ��״���CO(g)��2H2(g)![]() CH3OH(g)����һ�ݻ��ɱ���ܱ����� �г���10mol CO��20mol H2��CO��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ��
CH3OH(g)����һ�ݻ��ɱ���ܱ����� �г���10mol CO��20mol H2��CO��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ��

������˵�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_________������ĸ����
a��H2���������ʵ���CH3OH���������ʵ�2��
b��H2������������ٸı�
c����ϵ��H2��ת���ʺ�CO��ת�������
d����ϵ�������ƽ��Ħ���������ٸı�
���Ƚ�A��B����ѹǿ��СPA__________PB�����������=������
�����ﵽ��ѧƽ��״̬Aʱ�����������Ϊ20L�������Ӧ��ʼʱ�Գ���10molCO��20molH2������ƽ��״̬Bʱ���������V��B����__________L��
��4��SO2��һ�������¿�����������ԭ��ء���ͼ�����øõ���������������װ��ʾ��ͼ��

���õ�صĸ�����Ӧʽ�� ��
�����������ı����1.12L����ʱ������ ������a��b������_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪��ͪ[ CH3COCH3��]����ʽ�ɱ�ʾΪ![]() ���ݼ���ʽ�ش��������⣺
���ݼ���ʽ�ش��������⣺![]() ����ʽ��____________________���ṹ��ʽ��___________��
����ʽ��____________________���ṹ��ʽ��___________��
��2��![]() ����������� ______________��̼ԭ�ӹ�ֱ�ߣ������__________��ԭ�ӹ�ƽ�档
����������� ______________��̼ԭ�ӹ�ֱ�ߣ������__________��ԭ�ӹ�ƽ�档
��3��д����ϩ���ӵĵ���ʽ��____________________��
��4�����(CH3)2CHCH(C2H5)CH=CH2������____________________________��
��5����ͼ����4��̼ԭ�ӹ��ɵ�6���л���(��ԭ��û�л���)���Իش��������⣺

��Ϊͬ���칹�����________________________________��e�����������ŵ�����Ϊ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com