
【化学—选修2:化学与技术】(15分)
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
Ⅰ.氮的化合物是重要的化工产品。其生产方法也在逐渐改进中,各国科学家均在为提高其产量,降低能耗做各种有益的探究。
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g)==2NH3(g),ΔH="-92.4kJ/mol" 。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_________________________________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是 ;与传统的合成氨的方法比较,该方法的优点是 。
Ⅱ.(3)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是 。
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(4) 铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中 的U4+,而不吸附其他元素。其反应原理为 (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为: 。
(15分)(1)该反应是可逆反应,反应不完全(1分)
(2)在电磁场的作用下氮氮叁键更容易断裂,降低了合成反应所需的能量,反应容易进行。(2分)节能减排,降低了设备要求。(2分)
(3)①在HCl气流中(2分) ②不同意,因为MgO熔点很高,熔融时因耗费大量的能量而增加生产成本(2分)
(4)4HR+U4+=UR4+4H+ (3分) UR4+4H+=4HR+U4+ (3分)
解析试题分析:(1)该反应是可逆反应,反应物不会全部转化为生成物;
(2)电磁场存在的条件下,合成氨的温度、压强都比较低,说明电磁场的作用使反应的活化能降低,反应容易进行;因为反应的条件降低,所以这种方法对设备的要求不高,而且节能减排;
(3)①MgCl2水解生成氢氧化镁和氯化氢,加热,促进水解,为防止其水解,MgCl2·6H2O在氯化氢的气流中加热得到无水MgCl2,所以一定条件是指在HCl气流中;
②不同意;因为氧化镁的熔点较高,电解熔融的氧化镁需要的能量大,增加成本,所以不能电解氧化镁,而电解氯化镁;
(4)根据题意可知树脂HR只吸附U4+,所以与氢离子发生交换,反应原理为4HR+U4+=UR4+4H+ ;
发生离子交换后的离子交换膜用酸处理,再次发生离子交换,得到含铀的溶液,反应原理为UR4+4H+=4HR+U4+ 。
考点:考查化学与能量的关系,合成氨的改进,镁的制备,离子交换树脂的反应原理的判断


科目:高中化学 来源: 题型:单选题
下列有关海水综合利用的说法正确的是
| A.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B.用惰性电极电解MgCl2饱和溶液,可制得金属镁 |
| C.从海水中可以得到NaCl,电解熔融NaCl可制得金属钠 |
| D.从海带中提取碘单质的过程不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能源与人类的生活和社会发展密切相关,下列关于能源开发和利用的说法中,你认为说法不正确的是( )
| A.充分利用太阳能 |
| B.因地制宜开发利用风能、水能、地热能、潮汐能 |
| C.合理、安全开发利用氢能、核能 |
| D.能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨反应(N2+3H2 2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。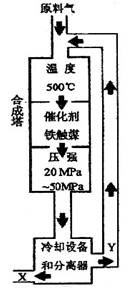
30. X的化学式为 ;X的状态为_______态。
31. 据右图分析,下列说法正确的是 (填写编号)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
32. 常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水的离子积常数的数值是_______________________;
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,
溶液中离子浓度由大到小依次为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列反应原理不符合工业冶炼金属实际情况的是( )。
A.2HgO 2Hg+O2↑ 2Hg+O2↑ | B.Fe3O4+4CO 3Fe+4CO2 3Fe+4CO2 |
C.2MgO 2Mg+O2↑ 2Mg+O2↑ | D.2Ag2O 4Ag+O2↑ 4Ag+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海南省是海洋大省,海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。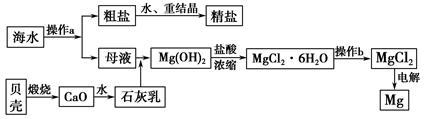
回答下列问题:
(1)流程图中操作a的名称为_________________________________________。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①则气体A应是_______________(填化学式),其过程反应方程式为_______________________________。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是_______________________________________________。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。操作b是在__________气氛中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式_________________________________________。
(4)一氯碱厂每天消耗234吨NaCl,这些NaCl能生产质量分数为32%的烧碱溶液__________吨,同时转移__________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co,工艺流程简图如下: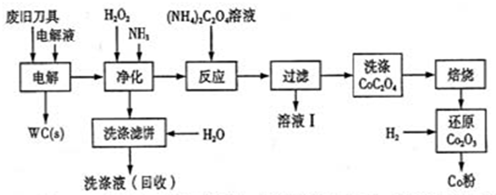
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液,阴极主要的电极反应为 ;
(2)净化步骤所得滤饼的主要成分是Fe(OH)3,回收的洗涤液代替水配制电解液,目的是回收利用其中的 ;
(3)溶液I的主要成分是NH4Cl,洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是 ;
(4)将Co2O3还原成Co粉的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化工生产原理错误的是( )
①可以电解熔融的氯化钠来制取金属钠;②可以将钠加入氯化镁饱和溶液中制取镁;③用电解法冶炼铝时,原料是氯化铝;④高炉炼铁的反应是放热的,故无需加热
| A.②③ | B.①③ |
| C.①②③ | D.②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com