
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
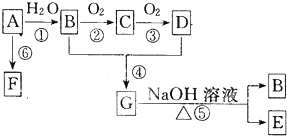
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2 |
| B、Cl2O |
| C、ClO2 |
| D、Cl2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 铜 |
| B | 胆矾 | 石灰水 | 硫酸钡 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| D | 纯醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
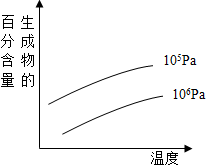 由可逆反应测绘出的图象如图所示,纵坐标为生成物在平衡体系中的百分含量,下列对该反应判断正确的是( )
由可逆反应测绘出的图象如图所示,纵坐标为生成物在平衡体系中的百分含量,下列对该反应判断正确的是( )| A、反应物中一定有气体 |
| B、生成物中一定无气体 |
| C、正反应一定是放热反应 |
| D、正反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )| A、分子式为C17H23O3 |
| B、该有机物难溶于水 |
| C、该有机物跟FeCl3溶液作用显紫色 |
| D、1mol该物质最多可与2mol NaOH发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com