
【题目】【2016届北京东城一模】下列叙述正确的是( )
A.NaOH可用于治疗胃酸过多
B.CaO可防止月饼等食品氧化变质
C.氢弹中用到的2H、3H互为同位素
D.向海水中加入净水剂明矾可以使海水淡化
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是
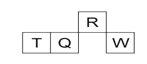
A. 最简单气态氢化物的热稳定性:R > Q
B. 含 T 的盐溶液一定显酸性
C. 原子半径:T > Q > R
D. 最高价氧化物对应水化物的酸性:Q < W
查看答案和解析>>
科目:高中化学 来源: 题型:
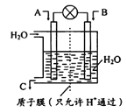
【题目】NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将NO2 转化为重要化工原料C。
若A为NO2,B为O2,则负极的电极反应式为___________;
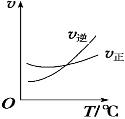
(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、
聚酯类材料的生产,工业上通过
Cl2(g)+CO(g) ![]() COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
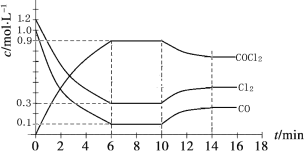
0~6 min内,反应的平均速率v(Cl2)= ;
保持温度不变,在第7min 向体系中加入这三种物质各2mol,则平衡向____________ 方向移动(填“正反应”、“逆反应”或“不”);
将初始投料浓度变为c(Cl2)=0.7mol/L、c(CO)=0.5mol/L、c(COCl2)=______ mol/L,
保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
温度升高,该反应平衡常数变化的趋势是______;(填“增大”、“减小”或“不变”)
比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8)_____T(15)
(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子在指定的分散系中能大量共存的一组是( )
A.空气:HCl、CO2、SO2、NO
B.烧碱溶液:K+、HCO![]() 、NO
、NO![]() 、NH3·H2O
、NH3·H2O
C.高锰酸钾溶液:H+、Na+、SO![]() 、CH3COOH
、CH3COOH
D.氢氧化铁胶体:H+、K+、S2-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在天平上准确称取烧碱样品wg,在烧坏中加蒸馏水溶解
B.在250mL容量瓶中定量成250mL烧碱溶液
C.用移液管移取25.00 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂
D.将物质的量浓度为 Cmol/L 的标准盐酸 溶液装入酸式滴定管,调整液面,记下开始刻度数为Vml
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点耗酸体积 V1ml
回答下列问题:
(1)操作中的雏形瓶下垫一张白纸的作用是__________________。
(2)操作中液面应调整到零刻度或零刻度以下(稍下)的某一刻度,尖嘴部分应___________。
(3)滴定终点时锥形瓶内溶液颜色变化是__________。
(4)若酸式滴定管没有用标准 润洗,会对测定结果有何影响_____________(填偏高、偏低或无影响,其他操作均正确)。
(5)该烧碱样品的纯度计算式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应最符合绿色化学原子经济性要求的是( )
A. 乙烷与氯气制备一氯乙烷
B. 在FeBr3催化作用下,苯与液溴反应制取溴苯
C. 苯和硝酸反应制备硝基苯
D. 乙烯与氧气在银催化作用下生成环氧乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的有机化工原料,它可以用玉米、
薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。结合有关知识,回答下列问题:
(1)写出乙醇与金属钠反应的化学方程式 ;
(2)在试管里加入2mL乙醇。把一端弯成螺旋状的铜丝放在酒精灯外焰中加热,使铜丝表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管玻璃管里(如右图),取出铜丝,可以观察到铜丝表面 ,整个实验实质是乙醇与氧气反应,化学方程式为 ,检验该反应生成物的试剂是 ;

(3)下列的说法中,正确的是 (填字母序号)。
A.乙醇汽油是一种纯净物,属于可再生能源
B.使用乙醇汽油,可以节省石油资源,减少尾气的排放,保护环境
C.乙醇与乙酸反应生成的乙酸乙酯是一种无色透明、密度比水小的油状液体
D.若用 CH3CH218OH和 CH3COOH发生酯化反应,则乙酸乙酯中不含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
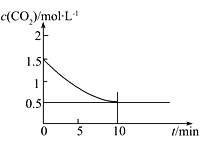
①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时![]() 增大的是__________(填序号) 。
增大的是__________(填序号) 。
A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a. 容器中的压强不变 b.气体的密度不再改变
c. v正(CO2)=v逆(CO) d. c(CO2)=c(CO)
e. 容器内气体总物质的量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com