
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在天平上准确称取烧碱样品wg,在烧坏中加蒸馏水溶解
B.在250mL容量瓶中定量成250mL烧碱溶液
C.用移液管移取25.00 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂
D.将物质的量浓度为 Cmol/L 的标准盐酸 溶液装入酸式滴定管,调整液面,记下开始刻度数为Vml
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点耗酸体积 V1ml
回答下列问题:
(1)操作中的雏形瓶下垫一张白纸的作用是__________________。
(2)操作中液面应调整到零刻度或零刻度以下(稍下)的某一刻度,尖嘴部分应___________。
(3)滴定终点时锥形瓶内溶液颜色变化是__________。
(4)若酸式滴定管没有用标准 润洗,会对测定结果有何影响_____________(填偏高、偏低或无影响,其他操作均正确)。
(5)该烧碱样品的纯度计算式是_____________。
【答案】(1)便于准确判断滴定终点时溶液的颜色变化情况。(2)充满溶液无气泡。
(3)指示剂颜色由黄色变为橙色。(4)偏高。因标准酸浓度变小,用量变大。
(5) 40C(V1-V)/w %
【解析】
试题分析:(1)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(2)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;
(3)指示剂为甲基橙,变色范围为3.1~4.4,终点时pH约为4,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
(4)因标准液浓度变小,用量变大,结果偏高;
(5)滴定消耗的盐酸为:n(硫酸)=cV=(V1-V)×10-3L × Cmol/L,根据反应方程可知,n(NaOH)=n(盐酸)=C(V1-V)×10-3mol,所以原来样品中氢氧化钠的物质的量为:=C(V1-V)×10-3mol×![]() =C(V1-V)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=40C(V1-V)×10-2g,则该烧碱样品的纯度为:
=C(V1-V)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=40C(V1-V)×10-2g,则该烧碱样品的纯度为:![]() ×100% =
×100% = ![]() .
.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】磷单质及其化合物有广泛应用。
(1)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,三聚磷酸钠(俗称“磷酸五钠”)是常用的水处理剂,其化学式为___________________。
(2)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为____________。
②化学镀镍的溶液中含有Ni2+和H2PO![]() ,在酸性条件下发生下述反应,请配平:
,在酸性条件下发生下述反应,请配平:
Ni2++_______H2PO![]() +_______
+_______![]() =_______Ni++_______H2PO
=_______Ni++_______H2PO![]() +_______
+_______![]()
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为
2Ca3(PO4)2+6SiO2![]() 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10![]() P4+10CO
P4+10CO
若反应生成31 g P4,则反应过程中转移的电子数为____________(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO![]() 、Fe2+、NH
、Fe2+、NH![]() 、H+和H2O,下列叙述正确的是( )
、H+和H2O,下列叙述正确的是( )
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂物质的量之比为8∶1
C.若有1 mol NO![]() 发生氧化反应,则转移电子5 mol
发生氧化反应,则转移电子5 mol
D.若将该反应设计成原电池,则负极反应为Fe3++e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于由锌片、铜片和稀硫酸组成的原电池的说法中,正确的是 ( )
A.电解质溶液的pH保持不变
B.电流方向是由锌片流向铜片
C.锌片作正极,发生还原反应
D.锌片质量逐渐减少,铜片上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届北京东城一模】下列叙述正确的是( )
A.NaOH可用于治疗胃酸过多
B.CaO可防止月饼等食品氧化变质
C.氢弹中用到的2H、3H互为同位素
D.向海水中加入净水剂明矾可以使海水淡化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1 mol·L-1NaHCO3溶液,下列说法正确的是( )
A.溶质水解反应:HCO+H2O=H3O++CO
B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO)+c(CO)
C.微粒浓度关系:c(Na+)>c(HCO)>c(H2CO3)>c(CO)
D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO)+c(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
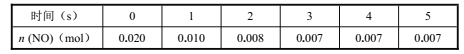
【题目】在2L密闭容器内,800℃时反应:![]() 体系中,n(NO)随时间的变化如下表:
体系中,n(NO)随时间的变化如下表:
[转化率=(某反应物转化的物质的量/该反应物起始的总的物质的量)×100%]
(1)上述反应 (填“是”或“不是”)可逆反应,在第 5s时,NO的转化率为 ;
(2)下图中表示 NO2变化曲线的是 ;用 O2表示 0~2s内该反应的平均速率υ= ;
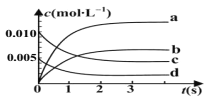
(3)能说明该反应已达到平衡状态的是 (填字母序号)。
A.υ(NO2)=2υ(O2) B.容器内压强保持不变
C.υ逆(NO)=2υ正(O2) D.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是( )
A. 淀粉的含量
B. 二氧化硫的含量
C. 亚硝酸盐的含量
D. 甲醛的含量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com