
【题目】功能高分子P的合成路线如下,其中反应⑥发生了加聚反应。

请回答下列问题:
(1)A的结构简式为____________________,试剂a是_______________________。
(2)反应②的反应类型是___________,E中含有的官能团有___________________。
(3)反应⑥的条件是____________________________。
(4)写出E的一种具有六元环酯的同分异构体的结构简式___________________。
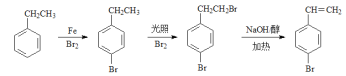
(5)写出由乙苯制取对溴苯乙烯(![]() )的合成路线(无机试剂任选):___________________(合成路线表示方法为:A
)的合成路线(无机试剂任选):___________________(合成路线表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
【答案】![]() 浓硝酸、浓硫酸 取代反应 碳碳双键、酯基 浓硫酸、加热
浓硝酸、浓硫酸 取代反应 碳碳双键、酯基 浓硫酸、加热 ![]()
【解析】
(1)采用逆合成分析法可知,D为![]() ,所以反应③应为氯原子水解生成羟基的过程,则B应为硝基苯,因此结合A的分子式C7H8,可知A为
,所以反应③应为氯原子水解生成羟基的过程,则B应为硝基苯,因此结合A的分子式C7H8,可知A为![]() ,试剂a为浓硝酸、浓硫酸,生成的B为
,试剂a为浓硝酸、浓硫酸,生成的B为![]() ,在氯气光照条件下发生取代反应,生成C,则C为
,在氯气光照条件下发生取代反应,生成C,则C为![]() ,C在氢氧化钠水溶液中加热发生取代反应生成D,易知D为
,C在氢氧化钠水溶液中加热发生取代反应生成D,易知D为![]() ,再通过酯化反应得到高分子P,因此G应为
,再通过酯化反应得到高分子P,因此G应为 , F转化G的过程发生了水解反应,则F为
, F转化G的过程发生了水解反应,则F为 ,又因为反应④为加聚反应,根据逆分析法可知,E为
,又因为反应④为加聚反应,根据逆分析法可知,E为![]() ,据此分析作答。
,据此分析作答。
根据上述分析可知,
(1)A的结构简式为![]() ,反应①为硝化反应,所以试剂a是浓硝酸、浓硫酸,
,反应①为硝化反应,所以试剂a是浓硝酸、浓硫酸,
故答案为:![]() ;浓硝酸、浓硫酸;
;浓硝酸、浓硫酸;
(2)反应②是氯气光照条件下发生的取代反应,E为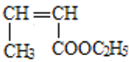 ,其中含有的官能团为碳碳双键与酯基,
,其中含有的官能团为碳碳双键与酯基,
故答案为:取代反应;碳碳双键、酯基;
(3)反应⑥为酯化反应,其反应条件是浓硫酸、加热,
故答案为:浓硫酸、加热;
(4)根据E的分子式可知其不饱和度为![]() =2,则其同分异构体中,具有六元环酯的同分异构体的结构简式之一为
=2,则其同分异构体中,具有六元环酯的同分异构体的结构简式之一为![]() ,
,
故答案为:![]() ;
;
(5)由乙苯制取对溴苯乙烯(![]() ),可先进行溴代反应,然后光照条件在乙基上发生取代反应,最后再氢氧化钠醇溶液中加热条件下得的对溴苯乙烯,其合成路线具体如下:
),可先进行溴代反应,然后光照条件在乙基上发生取代反应,最后再氢氧化钠醇溶液中加热条件下得的对溴苯乙烯,其合成路线具体如下: ,
,
故答案为: 。
。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】在浓度均为4.0 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的锌粉,充分反应后生成气体体积比为2∶3,则加入锌粉的质量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正四面体烷是一种可能存在的柏较图轻,IUPAC名称为三环[1. 1. 0. 0]丁烷。其球棍模型如图所示。下列关于该化合物的说法正确的是

A. 与环丁二烯互为同分异构体
B. 二氯代物超过两种
C. 碳碳键键角为109°28'
D. 三环[1.1. 0.0] 丁烷生成1 mol 丁烷至少需要2mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH=________(填“<”、“>”或“=”)0。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________。
(3)判断该反应是否达到平衡的依据为________。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时,反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。10.1g该样品与50mL1mol/L硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
A. 78B. 140C. 156D. 172
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关说法正确的是
A. 235g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]()
![]()
![]() +
+![]() +10
+10![]() 净产生的中子(
净产生的中子(![]() )数为10NA
)数为10NA
B. 常温下,0.5L pH=14的Ba(OH)2溶液中OH-数目为NA
C. 一定条件下,32gSO2与足量O2反应,转移的电子数为NA
D. 标准状况下,5.6L乙烷中含有的极性键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2O4(g)![]() 2NO2(g) ΔH=+57.20 kJ/mol,t℃时,将一定量的NO2、N2O4充入一个容积为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) ΔH=+57.20 kJ/mol,t℃时,将一定量的NO2、N2O4充入一个容积为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
下列推断不正确的是
A. c(X)代表NO2的浓度
B. 20min时改变的条件是向容器中加入0.8molNO2
C. 该反应的平衡常数K=0.9 mol/L
D. 25min后混合气体的平均摩尔质量为64.4g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带活塞的密闭容器中,当反应2NO2(g) ![]() N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是( )
N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是( )
A. 升高温度,气体颜色加深,则此正反应为吸热反应
B. 慢慢压缩气体体积,平衡向右移动,混合气体颜色较原来深
C. 慢慢压缩气体使体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入惰性气体,压强增大,平衡不会移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol。在25℃时,向恒容密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量Q1;若25℃时在此恒容密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量Q2。则下列关系正确的是
2SO3(g) △H=-197kJ/mol。在25℃时,向恒容密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量Q1;若25℃时在此恒容密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量Q2。则下列关系正确的是
A. Q2>Q1>197 kJ B. 2Q2<Q1<197 kJ
C. 2Q2=Q1=197 kJ D. 197 kJ> Q1=2Q2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com