
【题目】欲使NaCl、铁粉、SiO2的混合物分开,其必要的操作为
A. 升华、溶解、过滤、蒸发 B. 磁铁吸引、溶解、过滤、结晶
C. 溶解、过滤、萃取、分液 D. 加热、蒸馏、萃取、过滤
科目:高中化学 来源: 题型:
【题目】地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题。用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

作负极的物质是___________;正极的电极反应式是_____________。
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如下:

在pH =4.5的水体中,NO3-的去除率低的原因是_____________。
(3)为提高pH =4.5的水体中NO3-的去除率,某课题组在初始pH =4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图:

此实验可得出的结论是____,Fe2+的作用可能是_________。(2)中NO3-去除率和铁的最终物质形态不同的原因______________。
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有_______。(写出一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。回答下列问题:
(1)E是 ;
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号) 。
a.![]() b.
b.![]() c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是 (填写序号)

a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中 曲线(填写序号) 。
(5)②中C与D溶液等体积混合后溶液呈酸性的原因 (用离子方程式表示);若室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面.”这里的“石碱”是指
A. KOH B. KAl(SO4)2 C. KHCO3 D. K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是一种医药中间体.其结构简式如图所示。下列有关该物质的说法正确的是( )

A. 该化合物分子中不含手性碳原子
B. 该化合物与NaHCO3溶液作用有CO2气体放出
C. 1 mol该化合物与足量溴水反应,消耗2 mol Br2
D. 在一定条件下,该化合物与HCHO能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备BaCl2的工艺流程图如图:
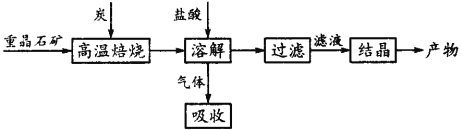
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s)+4C(s)![]() 4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
BaSO4(s)+2C(s)![]() 2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
(1)气体用过量的NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() ________________。
________________。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g) ![]() 2CO(g)的ΔH=____________kJ·mol-1。
2CO(g)的ΔH=____________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是:
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是:
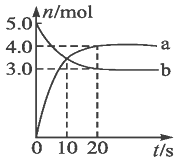
A.0-20 s内平均反应速率v(N2O5)=0.1 mol·L-1·s-1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 2mol/ L100ml的盐酸和锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com