
【题目】下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 2mol/ L100ml的盐酸和锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
科目:高中化学 来源: 题型:
【题目】欲使NaCl、铁粉、SiO2的混合物分开,其必要的操作为
A. 升华、溶解、过滤、蒸发 B. 磁铁吸引、溶解、过滤、结晶
C. 溶解、过滤、萃取、分液 D. 加热、蒸馏、萃取、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在0.2 mol·L-1Al2(SO4)3,溶液中,逐滴加入1.0mol·L-1NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B.a~b段,溶液pH增大,A13+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)已知NaHA水溶液呈碱性。
①用离子方程式及文字表示NaHA水溶液呈碱性的原因__________________。
②在NaHA水溶液中各离子浓度的大小关系是______________。
(2)25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为__________________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
Ⅱ.(5分)已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA -![]() H++A2-。试回答下列问题:(1)NaHA溶液呈________(填“酸”、“碱”或“中”)性,理由是___________________。
H++A2-。试回答下列问题:(1)NaHA溶液呈________(填“酸”、“碱”或“中”)性,理由是___________________。
(2)某温度下,向10mL、0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液VmL至中性,此时溶液中以下关系一定正确的是_________(填写字母)。
A.溶液pH=7 B.水的离子积Kw=[c2(OH-)]
C.V=10 D.c(K+)<c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、锌、稀硫酸、导线可组成原电池,则负极上发生的反应是
A. Cu-2e-=Cu2+ B. Zn-2e-=Zn2+ C. 2H2O+O2+4e-=4OH- D. 2H++2e-=H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面。查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如下:

(1)操作①的名称是____________,操作②的名称是___________。
(2)反应器Ⅰ中发生反应的化学方程式为________________________。
(3)反应器Ⅱ中发生反应的离子方程式为__________________________。
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为___________。
(5)若想得到201kg的HClO4纯品,至少需要NaClO3_________kg。
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:
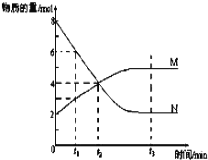
(1)该反应的化学方程式是____________________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,
发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B两种烃组成的混合气体,混合气体的平均相对分子质量随A的物质的量分数变化关系如图所示。
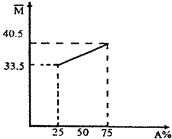
(1)A的相对分子质量是_______________。
(2)A、B化学式分别为___________、____________,A、B互为______________。
(3)A分子中碳原子_______在一条直线上(填“可能”、“一定”、“一定不”);A分子的二氯代物有______(填数目)种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com