
【题目】用酒精灯对下列实验仪器加热时,可以免用石棉网的是( )
A.试管
B.烧杯
C.锥形瓶
D.蒸馏烧瓶
科目:高中化学 来源: 题型:
【题目】市场上销售的香肠、盐水鸭、榨菜、豆腐干等食品,常采用真空包装,真空包装的目的是除去空气,使大多数微生物因缺少_________而受到抑制,停止繁殖,同时防止食品发生__________而变质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:
2SO2 (g)+O2 (g) ![]() 2SO3 (g) ΔH<0
2SO3 (g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=________。
(2)降低温度,该反应K值____________,二氧化硫转化率____________,化学反应速率_____________(以上均填“增大”“减小”或“不变”)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____________________。

(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________(用文字表达)。10 min~15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使NaCl、铁粉、SiO2的混合物分开,其必要的操作为
A. 升华、溶解、过滤、蒸发 B. 磁铁吸引、溶解、过滤、结晶
C. 溶解、过滤、萃取、分液 D. 加热、蒸馏、萃取、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含有少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了mg,则 ( )
A. 电解液质量增加mg B. 阴极质量增加xg,x>m
C. 阴极质量增加mg D. 阴极质量增加yg,y<m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如图所示①~④四个实验。下列推断正确的是

A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜(Cu2(OH)2CO3)是名贵的矿物宝石孔雀石的主要成分,应用广泛,如在无机工业中用于制造各种铜化合物,有机工业中用作有机合成催化剂等等,某化学小组为了探究碱式碳酸铜生成条件对其产率的影响,设计了如下实验:
设计原理:取一定体积的碳酸钠溶液(0.5mol/L)于100mL烧杯中,进行加热,恒温后将硫酸铜溶液(5.00mL,0.5mol/L)在不断搅拌下以一定速度逐滴加入到上述碳酸钠溶液中,反应达平衡后,静止,减压过滤,洗涤,烘干,即得到最终产品,同时有气体放出。
(1)反应原理为:________________________________ 。
(2)探究反应原料用量比对反应产物的影响。
该化学小组根据所提供试剂设计两个实验,来说明反应原料用量对产品的影响。
提供试剂:0.5mol/LNa2CO3溶液、0.5mol/L CuSO4溶液
①填写下表的空白处:_____________、_____________。

②通过实验画图可知:当比值为_____________ ,碱式碳酸铜产量最好。

(3)反应温度对产率的影响
在三支试管中各加入2.0 mL 0.5 mol·L-1CuSO4溶液,另取四支试管各加入由上述实验得到的合适用量的0.5 mol·L-1 Na2CO3溶液。从这两列试管中各取一支将它们分别置于室温、30℃、50℃、100℃的环境中,数分钟后将CuSO4溶液倒入Na2CO3溶液中振荡并观察现象,发现:沉淀颜色分别为蓝色沉淀,绿色沉淀,深绿色沉淀,绿色中带有黑色沉淀,实验结果也如上图所示,请思考,为什么温度过高产率反而下降________________,该实验加热方式为_______________________。
(4)分析所制得的碱式碳酸铜的质量分数。
将已准确称量的0.5g试样放入300mL的锥形瓶中,加入5mL醋酸加热使其溶解,再用100mL水将其稀释。加入2.5gKI振荡混合,经过5分钟后,加入数滴淀粉溶液,用0.1mol/L的硫代硫酸钠溶液进行滴定。当_____________________ 时即达滴定的终点。
(5)反应的原理:2Cu2+ + 4I— == 2CuI + I2 ,I2+2 S2O32— == 2 I—+ S2O6 2—。 若消耗0.1mol/L硫代硫酸钠40 mL,则试样中铜的质量百分率为________________ 。
该溶液的滴定度为______________。(每毫升标准溶液相当于被测物质的质量,单位是g/mL或mg/mL)(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在0.2 mol·L-1Al2(SO4)3,溶液中,逐滴加入1.0mol·L-1NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B.a~b段,溶液pH增大,A13+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:
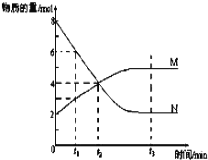
(1)该反应的化学方程式是____________________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,
发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com