
【题目】H、N、Na、Al、Ti等元素在能源、材料等领域应用广泛。回答下列问题:
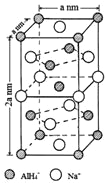
(一)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示,为长方体。
(1)基态Ti原子的价电子排布图为_________,L能层中电子云的形状有_______种。
(2)AlCl3在178℃时升华,属于__________晶体,其蒸气的相对分子质量约为267,蒸气分子的结构式为___________(标明配位键),其中Al的轨道杂化方式为____________。
(3)写出与AlH4-空间构型相同的一种分子和一种离子_________(填化学式)。
(4)NaAlH4晶体中,与AlH4-紧邻且等距的Na+有__________个;NaAlH4晶体的密度为_____________g·cm-3(用含a的代数式表示)。
(二)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
(1)写出与N3-属于等电子体的一种分子__________(填分子式)。
(2)氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
【答案】 (1)![]() 2 分子
2 分子  sp3 NH4+、CH4(或SO42-、PO43-、CCl4等其他合理答案) 8
sp3 NH4+、CH4(或SO42-、PO43-、CCl4等其他合理答案) 8 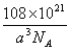 CO2或N2O DE
CO2或N2O DE
【解析】分析:钛是22号元素。L层只有s和p两种原子轨道。根据氯化铝易升华,可以判断其为分子晶体。根据中心原子所形成的σ键数目及孤电子对数可以确定其杂化类型。AlH4-空间构型为正四面体。根据均摊法可以计算出晶胞中的微粒数,再以1mol晶胞为单位,计算其体积和质量,即可求出其密度。等电子体之间原子数目相同、价电子总数相同。
详解:(一)(1)钛是22号元素,基态Ti原子的价电子排布图为![]() 。L能层中有s和p丙种轨道,故电子云的形状有2种。
。L能层中有s和p丙种轨道,故电子云的形状有2种。
(2)AlCl3在178℃时升华,说明其熔点和沸点较低,故其属于分子晶体,其蒸气的相对分子质量约为267,则蒸气分子的分子式为Al2Cl6,分子中有2个配位键,其结构式为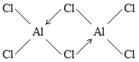 ,其中Al形成4个σ键、无孤电子对,故其轨道杂化方式为sp3。
,其中Al形成4个σ键、无孤电子对,故其轨道杂化方式为sp3。
(3)AlH4-空间构型为正四面体,与AlH4-空间构型相同的分子和离子主要有CCl4、CH4、SO42-、PO43-、NH4+等。
(4)由NaAlH4晶体的晶胞结构可知,,与AlH4-紧邻且等距的Na+有8个(如图所示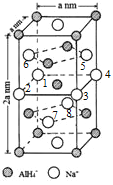 ,位于体心的AlH4-与其周围的8个Na+等距,距离为
,位于体心的AlH4-与其周围的8个Na+等距,距离为![]() );由均摊法可以求出该晶胞中阴阳离子的数目均为4,则NA个晶胞的质量和体积分别为216g和2
);由均摊法可以求出该晶胞中阴阳离子的数目均为4,则NA个晶胞的质量和体积分别为216g和2![]() ,所以,NaAlH4晶体的密度为
,所以,NaAlH4晶体的密度为![]() g·cm-3。
g·cm-3。
(二)(1)N3-有3个原子和16个价电子,故与N3-属于等电子体的分子有CO2或N2O。
(2)氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。A.上述生成HN3的化学方程式为N2H4+HNO2= HN3+2 H2O ,A正确;B.钠离子的半径小于钾离子,故NaN3的晶格能大于KN3的晶格能,B正确;C.氢叠氮酸(HN3)和水能形成分子间氢键,C正确;D.HN3是极性分子,N2H4是非极性分子,D不正确;E.HN3分子结构示意图为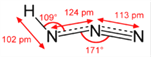 ,靠近H原子的第1个N原子是sp2杂化的,第二个N原子是sp杂化的,端位的N原子不杂化,故四个原子不在一条直线上,E不正确。综上所述,叙述错误的是DE 。
,靠近H原子的第1个N原子是sp2杂化的,第二个N原子是sp杂化的,端位的N原子不杂化,故四个原子不在一条直线上,E不正确。综上所述,叙述错误的是DE 。


科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是( )
A.Ba2+、Cl﹣、NO3﹣、Ca2+
B.H+、Na+、SO42﹣、CO32﹣
C.Cu2+、K+、Cl﹣、OH﹣
D.Ca2+、Na+、CO32﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 基态Si原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为_________。
(2) CH3COOH中C原子轨道杂化类型为_________;1molCH3COOH分子含有σ键的数目为_________。
(3) 复化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

①基态硼原子的电子排布式为__________。
②六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为__________,分析其结构,与石墨相似却不导电,原因是__________。
③NH4BF4 (氟硼酸铵)是合成氮化硼纳米管原料之一。1mol NH4BF4 含有__________mol 配位键。
(4) Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______,微粒之间存在的作用力是__________。
(5) 晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为金刚石的晶胞,其中原子坐标参数A为(0,0 ,0);B为(![]() ,0,
,0, ![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__________。
,0)。则D原子的坐标参数为__________。
②晶胞参数,描述晶胞的大小和形状,已知金刚石晶胞参数acm,其密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据金属及其化合物的所学知识回答下列问题:
(1)常温下,在没有氧气存在时,铁与水几乎不反应,但在高温时,铁能与水蒸气反应,写出化学反应方程式:_______________________________。
(2)待(1)中反应完全,反应产物中Fe元素化合价为_________,该产物与盐酸反应的离子方程式为:__________________________________。
(3)将铁粉投入到盛有Cu2+和Fe3+的溶液中,反应完毕时,若烧杯底部有固体剩余,在所涉及的金属元素内溶液中一定不含有的金属离子是________(填离子符号),写出证明溶液中不含有该离子的实验操作:______________________。
(4)某同学将铁、铜混合粉末14.8 g加入到100 mL 4.0 mol/L FeCl3溶液中,充分反应后,烧杯底部还有剩余固体,其质量为2.8 g,则原固体混合物中铜的质量是______g,反应所得溶液中的Fe2+物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:

己知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS 、CuO和SiO2等);
II.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29
回答下列问题:
(1)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是________(填化学式)。
(2)写出“还原”反应的化学方程式:______________ 。
(3)已知:浸出液中:c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______(填化学式);当CuS、PbS共沉时,![]() =_________。加入硫化钠的量不宜过多,原因是_________。
=_________。加入硫化钠的量不宜过多,原因是_________。
(4)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂、还原剂的物质的量之比___________。
(5)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
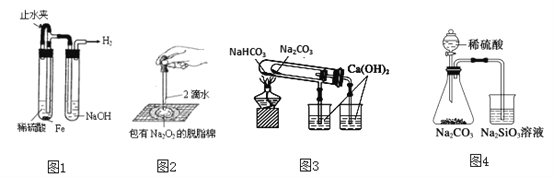
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变。
不变。
D. 向盐酸中加入氨水至中性,溶液中![]() >1
>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是______。
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
获取乙二醇的反应历程可分为如下2步:
Ⅰ.
Ⅱ.EC加氢生成乙二醇与甲醇
![]()
① 步骤Ⅱ的热化学方程式是______。
② 研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/ ℃ | EC转化率/ % | 产率/ % | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是______。温度升高到220 ℃时,乙二醇的产率反而降低,原因是______。
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a接电源的______极(填“正”或“负”),生成甲醇的电极反应式是______。

(4)CO2较稳定、能量低。为实现CO2的化学利用,下列研究方向合理的是______(填序号)。
a.选择高能量的反应物和CO2反应获得低能量的生成物
b.利用电能、光能或热能活化CO2分子
c.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2RO3是一种二元酸,常温下用1L1mol·L-1Na2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法正确的是
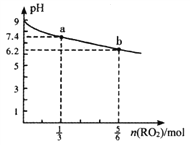
A. a点溶液中2c(Na+)=3c(RO32-)
B. 向b点溶液中加水可使溶液的pH由6.2升高到7.4
C. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D. 当吸收RO2的溶液呈中性时,c(Na+)=c(RO32-)+c(HRO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com