
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不与浓硫酸发生反应
B.过氧化钠可作为防毒面具和潜水艇内的供氧剂
C.可用稀硝酸鉴别铜锌合金制成的假金币
D.氢氟酸可用于雕刻玻璃
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】利用反应Zn + CuSO4 ═ Cu + ZnSO4 设计一个原电池。
(1) 在下面方格内画出实验装置图________.

(2)指出正极材料可以为_____________, 电极反应式是_______________;负极材料为_____________,电极反应式是_____________________________.
(3)若反应过程中有0.2mol电子通过,则溶解Zn的质量为________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
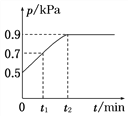
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应可表示为:
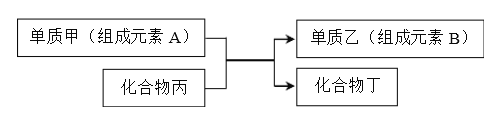
回答下列问题:
(1)下列物质能由化合反应制得,但不能由单质与酸发生置换反应得到的是__________。
A.AgCl B.FeCl2 C.AlCl3 D.FeCl3
(2)若A、B都是短周期元素,且B的原子序数是A两倍。则A在元素周期表中的位置
是_____________。
(3)若乙是一种常见半导体材料,工业上利用上述反应制取乙的化学方程式为____________。
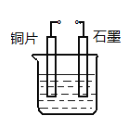
(4)若甲是Cu,乙是H2,某学生设计如图电化学装置实现该置换反应。则铜片为________极(填“正”、“ 负”、“ 阴”、“ 阳”),石墨上的电极反应______________。
(5)若甲是铝,丙是Fe3O4。过量的甲与丙完全反应后,欲从反应产物中分离出单质乙的化学方法是_______________。
(6)Cl2和NH3可发生置换反应。室温下,抽去下图所示装置中的玻璃片,使Cl2和NH3充分反应。
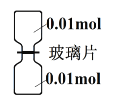
①NH3在___________瓶(填“上”或“下”) ;
②反应中,被氧化的B 元素与未被氧化的B 元素之比是_________;
③反应后取集气瓶壁附着的固体溶于适量水中,所得溶液中各离子浓度由大到小的顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢硫酸中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
A. 加水,会使平衡向右移动,溶液中氢离子浓度增大
B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大
D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为验证SO2的还原性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:_____________,你预测的理论依据是(用离子方程式表示):________________________。
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_______________。
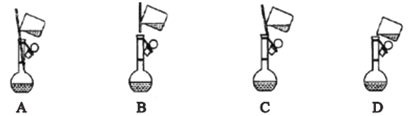
②测溶液的pH得知溶液呈酸性,其原因是:____________________ (用离子方程式表示)。
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_______________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HC1酸化”的目的是:_______________。
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com