
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )
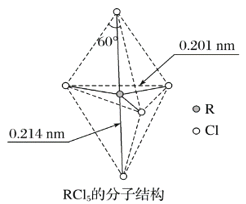
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D. 分子中5个R—Cl键键能不相同
【答案】B
【解析】
A.R元素最外层有5个电子,形成5个共用电子对,所以RCl5分子的最外层电子数为10,不满足8电子稳定结构,A项错误;
B.上、下两个顶点的原子与中心R原子形成的键角为180°,中间的平面三角形中,中心原子与三个项点的原子形成的键角为120°,中心原子与上、下顶点原子、与此三角形平面项点的原子形成的键角为90°,所以键角(Cl—R—Cl)有90°、120°、180°几种,B项正确;
C.由图可知RCl5分子空间构型是高度对称的,形成非极性分子,而RCl3是三角锥形结构,其分子是极性分子,C项错误;
D.分子上、下顶点的Cl原子与R原子形成的键长相同,键能相同,平面上正三角形顶点三个Cl原子与R原子形成的键长相同,键能相同,D项错误;
所以答案选择B项。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.0 | 0.27 | 0.012 |
(1)由表中数据判断ΔH1________(填“>”、“<”或“=”)0;反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
(2)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是________(填字母序号)
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂
(3)保持恒温恒容条件对于反应Ⅱ:将10 mol CO2和30mol H2放入1 L的密闭容器中,充分反应后测得CO2的转化率为60%,则该反应的平衡常数为____________________。若维持条件不变向该容器中投入10 mol CO2、30mol H2、10 mol CH3OH(g)和 10mol H2O(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”)。
(4)反应Ⅰ的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是( )
A.甲烷、辛醛B.丙炔、苯乙烯C.甲醛、甲酸甲酯D.苯、甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究.为测定黄铜矿中硫元素的质量分数,将m1 g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品.

(1)锥形瓶A内所盛试剂是_________;装置B的作用是_________;锥形瓶D内发生反应的离子方程式为:_______________________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:

如图向锥形瓶D中加入过量H2O2溶液反应的离子方程式为_________;操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法________;该黄铜矿中硫元素的质量分数为_________(用含m1、m2的代数式表示)。
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是__________。
A.KSCN溶液、氯水
B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液
D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )
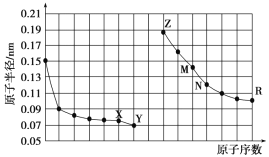
A. M、N的氧化物都能与Z、R的最高价氧化物对应水化物反应
B. Y的单质能从含R简单离子的水溶液中置换出R单质
C. X、M两种元素组成的化合物熔点很高
D. 简单离子的半径:R>M>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾别名为红矾钾,室温下为橙红色晶体,溶于水,不溶于乙醇。它被国际癌症研究机构划归为第一类致癌物质,而且是强氧化剂,在实验室和工业中都有很广泛的应用。实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。相关资料如下:
序号 | 资料 |
① | Cr2(SO4)3溶液呈绿色 |
② | 酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2 |
③ | CrO5可溶于水,易溶于乙醚得到蓝色溶液 |
④ | 乙醚是一种无色不溶于水,密度比水小的有机溶剂,化学性质稳定 |
甲同学采用如图装置进行实验,探究了酸性条件下K2Cr2O7溶液和H2O2溶液的反应产物,实验步骤、操作等内容如下:
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装仪器 | —— |
Ⅱ | ? | —— |
Ⅲ | 向盛有H2O2溶液的仪器X中加入一定量的K2Cr2O7溶液和硫酸 | 溶液立即变为紫红色,此时pH=1,观察到溶液中持续产生气泡,最终溶液变为绿色 |
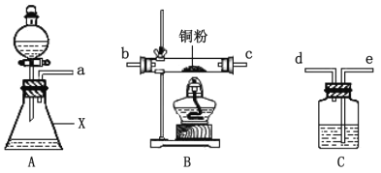
回答下列问题:
(1)用以上装置证明实验中产生的气体有氧气,装置的连接顺序是a→__→__→__→__。
(2)图中仪器X的名称是___。
(3)实验步骤Ⅱ是___。
(4)实验中紫红色溶液含有CrO5。
①验证紫红色溶液中含有CrO5的操作及现象是___。
②已知CrO5的结构式为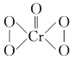 ,生CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
,生CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
(5)对上述实验中产生氧气、溶液变为绿色的原因,做出的假设①是CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。你还能做出的假设②是___。
(6)设计实验,选择合适的试剂,验证(5)中的假设①,你的设计是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期主族元素的原子序数依次增大,已知:
①其原子半径大小关系是D>E>B>C>A;
②A、D同主族,B、C、E分处三个连续的主族,且最外层电子数依次增加;
③C是地壳中含量最多的元素,D与C可形成原子个数比为1∶1或2∶1的化合物。
请填写以下空白:
(1)化合物D2C2的电子式为________________。
(2)用电子式表示D2C的形成过程:_______________________。
(3)单质A和单质B在一定条件下发生反应的化学方程式为____________________。
(4)单质E与A、C、D三种元素形成的化合物发生反应的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com