
【题目】下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。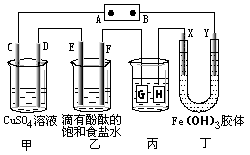
请回答:
(1)A极是电源的 , 一段时间后,甲中溶液颜色。丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明。在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为。
(3)现用丙装置给铜件镀银,则G应该是 (填“镀层金属”或“镀件”),电镀液是溶液。当乙中溶液的c(OH-)=0.1mol· L-1(此时乙溶液体积为1000mL),丙中镀件上析出银的质量为 , 甲中溶液的c(H+)pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是。
【答案】
(1)正极;逐渐变浅;氢氧化铁胶粒带正电荷
(2)1:2:2:2
(3)镀层金属;AgNO3;10.8g;变大
(4)Fe+Cu2+ ![]() Cu+Fe2+
Cu+Fe2+
【解析】(1)A电极是电源的正极,在A池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅;Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷;
(2)C、D、E、F电极发生的电极反应分别为:4OH-═O2↑+2H2O+4e-、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以G应该是镀层金属,电镀液含有镀层金属阳离子,故电镀液为AgNO3溶液;当乙中溶液的c(OH-)=0.1molL-1时(此时乙溶液体积为1000mL),根据电极反应2H2O+2e-═H2↑+2OH- , 则放电的氢离子的物质的量为:0.1mol/l×1L=0.1mol,当转移0.1mol电子时,丙中镀件上析出银的质量=108g/mol×0.1mol=10.8g,电解硫酸铜的过程中水放电生成氧气,有硫酸生成,所以氢离子浓度增大,所以酸性增强,甲中溶液的pH变小;
(4)C电极换为铁,则阳极铁失电子,阴极铜离子得电子,电解池反应为:Fe+Cu2+ ![]() Cu+Fe2+。(1)根据实验现象判断电解池的电极,进而得出电源的电极,然后进行分析即可;
Cu+Fe2+。(1)根据实验现象判断电解池的电极,进而得出电源的电极,然后进行分析即可;
(2)根据电荷守恒进行计算;
(3)根据电镀原理进行分析即可;
(4)活泼金属作阳极,则活泼金属被氧化。


科目:高中化学 来源: 题型:
【题目】利用下图装置做铝热反应实验。下列说法不正确的是( )
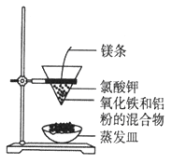
A.该反应的方程式是2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
B.该反应产生高温,发出强光
C.根据铝热反应原理,可以冶炼某些金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是

A. 溶液呈中性时: c(Na+)=2c(X2-)
B. Ka2(H2X)为10-7
C. NaHX溶液c( H+)< c(OH-)
D. 溶液pH由1开至2.6时主要存在的反应是: H2X +OH-=HX-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2) 被誉为“固体润滑剂之王”,利用低品质的辉钼矿( 含MoS2、SiO2以及CuFeS2等杂质) 制备高纯二硫化钼的一种生产工艺如下:
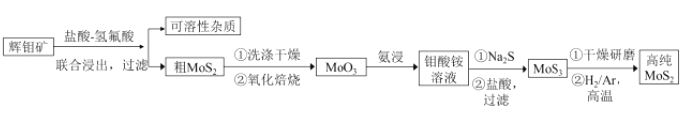
回答下列问题:
(1)钼酸铵的化学式为(NH4)2MoO4,其中Mo的化合价为________.
(2)利用联合浸出除杂时,氢氟酸可除去的杂质化学式为________如改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,写出氧化浸出时发生的化学反应方程式________。
(3)加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)MoS4],写出(NH4)2MoS4与盐酸生成MoS3沉淀的离子反应方程式____________。
(4)由下图分析产生三硫化钼沉淀的流程中应选择的最优温度和时间是___________。
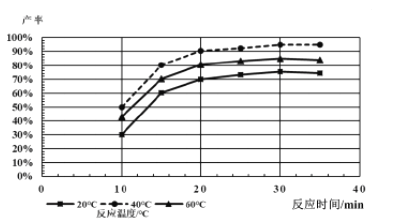
利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因:__________。
(5)高纯MoS2中3然会存在极微量杂质,如非整比晶体MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为________________。
(6)已知Ksp(BaSO4) =1.1×10-10,Ksp(BaMoO4)=4.0×10-8),钼酸钠品体( NaMoO4·2H2O) 是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的c(MoO42-)/c(SO42-)___________(结果保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是( )
A. 开始生成蓝色沉淀,加入过量氨水时,形成无色溶液
B. 开始生成Cu(OH)2,它不溶于水,但溶于浓氨水,生成深蓝色溶液
C. 开始生成蓝色沉淀,加入氨水后,沉淀溶解生成深蓝色溶液
D. 开始生成Cu(OH)2,之后生成更稳定的配合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】了解有机物分子中化学键特征以及成键方式是研究有机物性质的基础。下列关于有机物分子的成键方式的描述不正确的是( )
A. 烷烃分子中碳原子均采用sp3杂化轨道成键
B. 炔烃分子中碳碳叁键由1个σ键、2个π键组成
C. 甲苯分子中所有碳原子均采用sp2杂化轨道成键
D. 苯环中存在6个碳原子共有的大π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可构成原电池。试回答下列问题: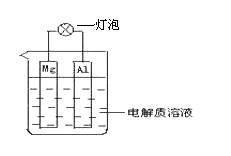
(1)电解质溶液为浓硝酸时,灯泡 (填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的反应为: ;
b.若灯泡不亮,其理由为:
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极反应式为: ;Al电极反应式为: 。
b.若灯泡不亮,其理由为: 。
(3)(Ⅰ)有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出):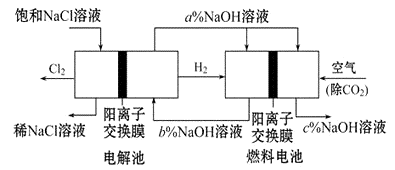
回答下列有关问题:
原电池的负极反应式为。
(4)a、b、c的大小关系为:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4 , 下列说法正确的是( )
A.O4和O2互为同位素
B.O4转化O2为物理变化
C.18O是氧元素的一种核素,它的中子数是8
D.同温同压下,等体积的O4气体和O2含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 欲实现铁上镀锌,用锌作阴极
B. 电解精炼铜,若转移2mol电子,阴极质量增加64g
C. 硫酸工业中采用沸腾炉以增大固气接触面积,加快反应速率
D. 镁的提取工业中,MgCl2·H2O在HCl气流中脱水以防止MgCl2水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com