
【题目】利用下图装置做铝热反应实验。下列说法不正确的是( )
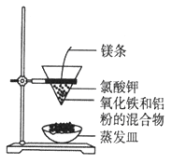
A.该反应的方程式是2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
B.该反应产生高温,发出强光
C.根据铝热反应原理,可以冶炼某些金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.生石灰与水作用制熟石灰
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)28H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________________。
I1.实验室模拟下图所示流程制备亚硝酸钠:

已知: ①氧化过程中,控制反应液温度在35~60℃条件下主要发生反应:
C6H12O6+ 12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO 和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是_____ ,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛裝的试剂除NaOH(aq)外,还可以是_____ (填字母)。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3( aq )
Ⅲ.测定产品纯度:
[实验步骤] ①准确称量ag 产品配成200mL溶液
②从步骤①配制的溶液中移取20.00mL 加入锥形瓶中
③用c mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3 次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为____________。
(2)产品中NaNO2 的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
A.原子序数:X<Y
B.原子半径:X<Y
C.离子半径:X>Y
D.最外层电子数:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C都是金属,把A浸入C的硫酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极.A,B,C三种金属的活动性顺序为( )
A.A>B>C
B.A>C>B
C.B>A>C
D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是实验室及生活中的常见物质。
(1)写出醋酸的电离方程式______________。
(2)常温下醋酸溶液的pH <7,用文字描述其原因是____________。
(3)能证明醋酸是弱酸的实验事实是(多选、错选不得分)_________。
a.同浓度的CH3COOH溶液和盐酸分别与相同的Mg条反应,放出H2的初始速率醋酸慢
b.0.1 mol·L-1 CH3COONa溶液的pH> 7
c.CH3COOH溶液与Na2CO3反应生成CO2
d.0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红
e. 常温下0.1mol/l醋酸溶液的pH>1
(4)25 ℃时,在体积均为20 mL、浓度均为0.1 mol·L-1的CH3COOH、HCl溶液中,分别逐滴加入浓度为0.1 mol·L-1的NaOH溶液,溶液pH随加入NaOH溶液体积变化如图所示。
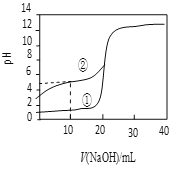
ⅰ.当加入NaOH溶液20 ml时,①溶液的离子浓度大小关系是____________ 。
ⅱ.当②溶液的pH=7时,溶液中存在的微粒浓度大小关系正确的是____________。
a.c(Na+)=c(Ac-)>c(HAc)>c(H+)=c(OH-)
b.c(Na+)=c(Ac-)>c(H+)=c(OH-)>c(HAc)
c.c(HAc)>c(Na+)=c(Ac-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
(1)CO2的电子式是_____________。
(2)反应Ⅰ的平衡常数表达式是K=______。
(3)对比①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
对比①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
(4)有利于提高CO2转化为CH3OH平衡转化率的措施有____。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.低反应温度
d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) ![]() 2N2+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是 ( )
2N2+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是 ( )
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。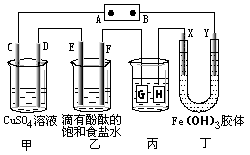
请回答:
(1)A极是电源的 , 一段时间后,甲中溶液颜色。丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明。在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为。
(3)现用丙装置给铜件镀银,则G应该是 (填“镀层金属”或“镀件”),电镀液是溶液。当乙中溶液的c(OH-)=0.1mol· L-1(此时乙溶液体积为1000mL),丙中镀件上析出银的质量为 , 甲中溶液的c(H+)pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com