
【题目】醋酸是实验室及生活中的常见物质。
(1)写出醋酸的电离方程式______________。
(2)常温下醋酸溶液的pH <7,用文字描述其原因是____________。
(3)能证明醋酸是弱酸的实验事实是(多选、错选不得分)_________。
a.同浓度的CH3COOH溶液和盐酸分别与相同的Mg条反应,放出H2的初始速率醋酸慢
b.0.1 mol·L-1 CH3COONa溶液的pH> 7
c.CH3COOH溶液与Na2CO3反应生成CO2
d.0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红
e. 常温下0.1mol/l醋酸溶液的pH>1
(4)25 ℃时,在体积均为20 mL、浓度均为0.1 mol·L-1的CH3COOH、HCl溶液中,分别逐滴加入浓度为0.1 mol·L-1的NaOH溶液,溶液pH随加入NaOH溶液体积变化如图所示。
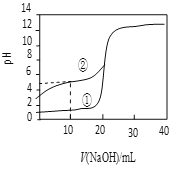
ⅰ.当加入NaOH溶液20 ml时,①溶液的离子浓度大小关系是____________ 。
ⅱ.当②溶液的pH=7时,溶液中存在的微粒浓度大小关系正确的是____________。
a.c(Na+)=c(Ac-)>c(HAc)>c(H+)=c(OH-)
b.c(Na+)=c(Ac-)>c(H+)=c(OH-)>c(HAc)
c.c(HAc)>c(Na+)=c(Ac-)>c(H+)=c(OH-)
【答案】 CH3COOHCH3COO-+H+ 醋酸可以电离出H+,溶液中c(H+)>c(OH-),因此溶液显酸性 abe c(Na+)= c(Cl-)>c(H+)=c(OH-) a
【解析】(1)醋酸是弱电解质,发生可逆电离,方程式为:CH3COOHCH3COO-+H+。
(2)判断溶液酸碱性是看溶液中的氢离子和氢氧根离子浓度的相对大小,所以醋酸溶液显酸性的原因是:醋酸电离出了氢离子使溶液中的氢离子浓度大于氢氧根离子浓度。
(3)同浓度的CH3COOH溶液和盐酸分别与相同的Mg条反应,放出H2的初始速率醋酸慢,说明醋酸溶液的氢离子浓度更小,即醋酸电离的少,所以说明醋酸为弱酸,选项a正确。0.1 mol·L-1 CH3COONa溶液的pH> 7,说明醋酸钠是强碱弱酸盐,即醋酸为弱酸,选项b正确。CH3COOH溶液与Na2CO3反应生成CO2,只能证明醋酸比碳酸强,不能证明醋酸是弱酸,选项c错误。0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红,只能证明醋酸溶液显酸性,不能证明其为弱酸选项d错误。常温下0.1mol/l醋酸溶液的pH>1,说明醋酸只电离的一部分,所以证明醋酸为弱酸,选项e正确。
(4)根据起点的pH就可以判断出来,曲线①为盐酸,曲线②为醋酸。当加入20mL的氢氧化钠的时候,曲线①表示的就是NaCl溶液,溶液显中性,钠离子和氯离子相等,所以有:c(Na+)= c(Cl-)>c(H+)=c(OH-)。当曲线②的溶液达到中性的时候,应该是醋酸和醋酸钠的混合溶液,此时氢离子和氢氧根离子浓度相等,所以根据电荷守恒得到:钠离子和醋酸根离子浓度相等,由上,只有选项a正确。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 固体SiO2一定是晶体
B. 晶体有固定的组成,非晶体没有固定的组成
C. 晶体内部的微粒按一定规律呈周期性有序排列
D. 冰和固体碘晶体中相互作用力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是某学生绘制的实验室分馏石油的装置图:
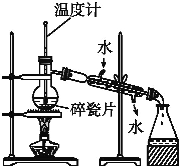
(1)实验室分馏石油的正确操作顺序是E→___→ →A→C→ → 。
A.连接接液管
B.装入碎瓷片(沸石)和石油,塞上带温度计的塞子
C.检查装置气密性
D.连接冷凝管及进出水管
E.在铁架台上放酒精灯,固定好铁圈,放上石棉网
F.固定好蒸馏烧瓶,调节好温度计的位置
G.加热
(2)装置图中有两处错误,它们分别是:
①冷凝管中进水口和出水口接反了;
②______________________________________________________。
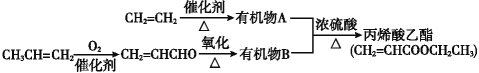
Ⅱ. 由石油裂化和裂解得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
根据以上材料和你所学的化学知识回答下列问题:
(3)由![]() 制得有机物A的化学方程式是________________,反应类型是___。
制得有机物A的化学方程式是________________,反应类型是___。
(4)由A与B合成丙烯酸乙酯的化学方程式是______________________,反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.能与酸反应的氧化物,一定是碱性氧化物
C.含金属元素的离子不一定都是阳离子
D.金属阳离子被还原后,一定得到该元素的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置做铝热反应实验。下列说法不正确的是( )
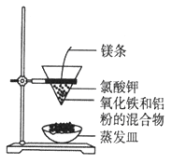
A.该反应的方程式是2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
B.该反应产生高温,发出强光
C.根据铝热反应原理,可以冶炼某些金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按照图1所示装置制备氯酸钾、氯水并进行有关探究实验。
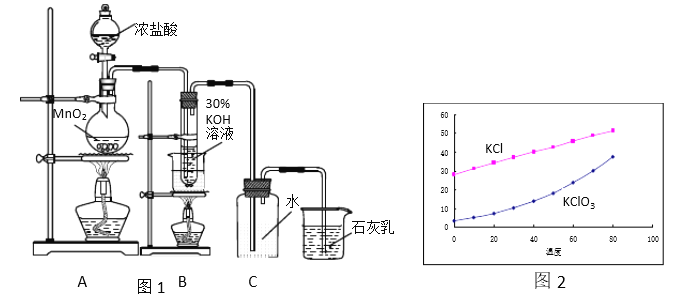
Ⅰ实验一 制取氯酸钾和氯水
(1)A中发生反应的化学方程式是_____________。
(2)制备KClO3需在70℃~80℃进行,写出制备KClO3的离子方程式______。
(3)装置C的作用是_____ 。
(4)KCl 和KClO3的溶解度如图2所示。反应结束后,将装置B中的溶液放到冰水浴中, 20秒后会析出较多晶体X。这样做是因为________(选填a、b、c):
a. KClO3溶解度受温度影响较大而KCl溶解度受温度影响较小
b. 0℃时,KClO3溶解度比KCl小
c. 溶液中的溶质主要是KClO3
所以在冷却过程中晶体X会沉淀析出,X的化学式是_______。
(5)上一步操作会不可避免地使另一种物质同时析出,因此要获得较纯净的X,需要进行的具体的操作步骤是_________________。
Ⅱ实验二 氯酸钾性质研究
(6)在不同条件下KClO3可将KI氧化为不同的产物。该小组设计了如下实验,研究反应条件对反应产物的影响(实验在室温下进行):
0.20 mol·L KI/ mL | KClO3(s) /g | 6.0 mol·L-1 H2SO4/ mL | 蒸馏水/ mL | |
试管1 | 1.0 | 0.10 | 0 | 9.0 |
试管2 | 1.0 | 0.10 | 3.0 | 6.0 |
①该实验的实验目的是__。
②设计试管1实验的作用是_____。
③实验后发现,试管2中产生黄色溶液,该同学预测KI被氧化为I2。用离子方程式表示该同学的预测____________;请设计2种实验方案验证该预测正确(从加入试剂、现象、结论等方面描述)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸H2A在水中存在下列电离:①H2A=H++HA- ②HA- ![]() H++A2- , 下列说法一定正确的是( )
H++A2- , 下列说法一定正确的是( )
A.Na2A溶液中一定有:c(OH-)= c(H+)+c(HA-)
B.Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性
C.Na2A溶液中一定有c(Na+)+c(H+)= c(OH-)+c(A2-) +c(HA-)
D.NaHA溶液一定有c(Na+)>c(HA) >c(OH-)>c(H2A) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】了解有机物分子中化学键特征以及成键方式是研究有机物性质的基础。下列关于有机物分子的成键方式的描述不正确的是( )
A. 烷烃分子中碳原子均采用sp3杂化轨道成键
B. 炔烃分子中碳碳叁键由1个σ键、2个π键组成
C. 甲苯分子中所有碳原子均采用sp2杂化轨道成键
D. 苯环中存在6个碳原子共有的大π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com