
【题目】向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是( )
A. 开始生成蓝色沉淀,加入过量氨水时,形成无色溶液
B. 开始生成Cu(OH)2,它不溶于水,但溶于浓氨水,生成深蓝色溶液
C. 开始生成蓝色沉淀,加入氨水后,沉淀溶解生成深蓝色溶液
D. 开始生成Cu(OH)2,之后生成更稳定的配合物
科目:高中化学 来源: 题型:
【题目】A,B,C都是金属,把A浸入C的硫酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极.A,B,C三种金属的活动性顺序为( )
A.A>B>C
B.A>C>B
C.B>A>C
D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭真空容器中,反应2BaO2(s) ![]() 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A. 平衡常数减小 B. BaO量不变 C. 氧气压强不变 D. BaO2量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知40℃时水的离子积常数为Kw。该温度下, 将浓度为 a mol/L的一元酸HA与 b mol/L的一元碱BOH等体积混合,该溶液呈中性时,下列叙述不正确的是
A. a=b,pH=7
B. 混合溶液的c(H+)=c(OH-)
C. 混合溶液中,c(B+) =c(A-)
D. 混合溶液中,c(OH-)= ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。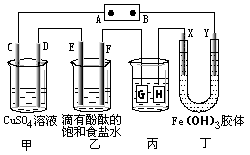
请回答:
(1)A极是电源的 , 一段时间后,甲中溶液颜色。丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明。在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为。
(3)现用丙装置给铜件镀银,则G应该是 (填“镀层金属”或“镀件”),电镀液是溶液。当乙中溶液的c(OH-)=0.1mol· L-1(此时乙溶液体积为1000mL),丙中镀件上析出银的质量为 , 甲中溶液的c(H+)pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活中具有重要作用。请按要求回答下列问题:
(1)海带灰浸取液中的碘元素以I-形式存在。现利用如下试剂:MnO2、稀硫酸、淀粉溶液,从中获取单质碘。请按要求完善下表:
序号 | 所选试剂 | 反应原理或现象或解释 |
方法1 | MnO2、稀硫酸 | 离子方程式:________ |
方法2 | 稀硫酸、淀粉溶液 | 溶液变蓝的原因。用离子方程式解释: ____________ |
(2)反应2HI(g) ![]() H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
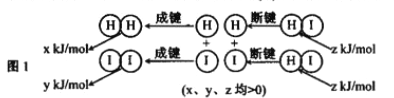

①比较2z______(x+y)(填 “<"、“>”或“=”).
②某温度下该反应的平衡常数K=1/9,达平衡时,HI的转化率=___________。
③只改变该反应的一个条件,试写出能提高HI转化率的两项措施:__________、_________。
(3)已知:i.分解1molH2O2放出热量98kJ;ⅱ.含少量I-的溶液中,H2O2的分解机为: H2O2+I-![]() H2O+IO-慢;H2O2+IO-
H2O+IO-慢;H2O2+IO-![]() H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:
H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:
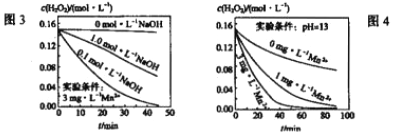
请完善由以上信息可得到的如下结论:
①H2O2分解反应的热化学方程式为___________。
②H2O2的分解速率与_________有关。
③“少量Mn2+存在时,溶液碱性越强H2O2分解速率越大”的结论是否正确_______(填“是"或“否”);c(Mn2+)对H2O分解速率的影响是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度是________。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com