
����Ŀ���⼰�仯�����������������о�����Ҫ���á��밴Ҫ��ش���������:
��1�������ҽ�ȡҺ�еĵ�Ԫ����I-��ʽ���ڡ������������Լ���MnO2��ϡ���ᡢ������Һ�����л�ȡ���ʵ⡣�밴Ҫ�������±�:
��� | ��ѡ�Լ� | ��Ӧԭ������������ |
����1 | MnO2��ϡ���� | ���ӷ���ʽ��________ |
����2 | ϡ���ᡢ������Һ | ��Һ������ԭ�������ӷ���ʽ����: ____________ |
��2����Ӧ2HI(g) ![]() H2(g)+I2(g)�������仯��ͼ1��ʾ:����������ͬ��1molHI�ڲ�ͬ�¶ȷֽ��ƽ��ʱ�������ϵ��n(I2)���¶ȱ仯��������ͼ2��ʾ��
H2(g)+I2(g)�������仯��ͼ1��ʾ:����������ͬ��1molHI�ڲ�ͬ�¶ȷֽ��ƽ��ʱ�������ϵ��n(I2)���¶ȱ仯��������ͼ2��ʾ��
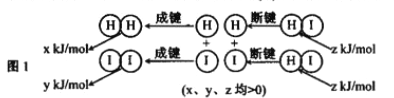

�ٱȽ�2z______(x+y)(�� ��<"����>������=��).
��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K=1/9,��ƽ��ʱ��HI��ת����=___________��
��ֻ�ı�÷�Ӧ��һ����������д�������HIת���ʵ������ʩ��__________��_________��
��3����֪:i.�ֽ�1molH2O2�ų�����98kJ����.������I-����Һ�У�H2O2�ķֽ��Ϊ: H2O2+I-![]() H2O+IO-����H2O2+IO-
H2O+IO-����H2O2+IO-![]() H2O+O2+I-�졣��.H2O2�ֽ������ܶ�������Ӱ�죬ʵ����ij�¶�ʱ��ͬ������H2OŨ����ʱ��ı仯��ͼ3��4��ʾ:
H2O+O2+I-�졣��.H2O2�ֽ������ܶ�������Ӱ�죬ʵ����ij�¶�ʱ��ͬ������H2OŨ����ʱ��ı仯��ͼ3��4��ʾ:
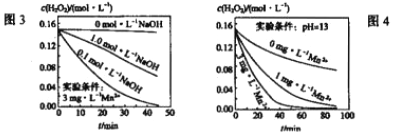
��������������Ϣ�ɵõ������½���:
��H2O2�ֽⷴӦ���Ȼ�ѧ����ʽΪ___________��
��H2O2�ķֽ�������_________�йء�
��������Mn2+����ʱ����Һ����ԽǿH2O2�ֽ�����Խ�����Ľ����Ƿ���ȷ_______(������"��������)��c(Mn2+)��H2O�ֽ����ʵ�Ӱ����__________��
���𰸡� MnO2+4H++2I- =Mn2++I2+2H2O O2+4H++4I-=2I2+2H2O > 40% ����I2 ���� 2H2O2(1) =2H2O(1) + O2(g) ��H=-196 kJ/mol c(I-)��c(Mn2+)����ҺpH �� c(Mn2+)Խ��H2O2�ֽ�����Խ��
��������(1).�����������£��������̰ѵ���������Ϊ�ⵥ�ʣ�������ԭΪMn2+����ȷ��Ϊ��
MnO2+4H++2I- =Mn2++I2+2H2O�����������������ӱ������е���������Ϊ�ⵥ�ʣ���ȷ��Ϊ��O2+4H++4I-=2I2+2H2O��
��2���ٸ���ͼʾ��֪���¶����ߣ���������÷�ӦΪ���ȷ�Ӧ�����Է�Ӧ��������С����������������2z> (x+y)����ȷ����>
�� 2HI(g) ![]() H2(g) + I2(g) �������������Ϊ1L
H2(g) + I2(g) �������������Ϊ1L
��ʼŨ�� 1 0 0
�仯Ũ�� 2x x x
ƽ��Ũ�� 1-2x x x
����ƽ�ⳣ�����㣺x2/(1-2x)2= K=1/9�����x=0.2mol/L
HI��ת����=2��0.2��1��100%=40%����ȷ�𰸣�40%��
�������������䣬�����������������Ũ�ȣ������¶ȶ��������HIת���ʣ���ȷ�𰸣�����I2 �� ���£�
��3����H2O2�ķֽ����Ϊ��H2O2+I-![]() H2O+IO-����H2O2+IO-
H2O+IO-����H2O2+IO-![]() H2O+O2+I-�졣����ʽ����Ӵ��������ΪH2O2�ֽⷴӦ�Ļ�ѧ����ʽ��Ȼ����ݷֽ�1molH2O2�ų�����98kJ ���Ϳ���д���Ȼ�ѧ����ʽ����ȷ��2H2O2(1) =2H2O(1) + O2(g) ��H=-196 kJ/mol��
H2O+O2+I-�졣����ʽ����Ӵ��������ΪH2O2�ֽⷴӦ�Ļ�ѧ����ʽ��Ȼ����ݷֽ�1molH2O2�ų�����98kJ ���Ϳ���д���Ȼ�ѧ����ʽ����ȷ��2H2O2(1) =2H2O(1) + O2(g) ��H=-196 kJ/mol��
�ڸ���2��ͼ��������H2O2�ķֽ�������c(Mn2+)��c(I-)����ҺpH���й�����ȷ����c(Mn2+)��c(I-)����ҺpH��
������Mn2+����ʱ������ͼ��3���Կ�������Һ�ļ���ԽС��H2O2�ֽ�����Խ����ȷ�𰸣�����ͼ��4���������Բ��������£�c(Mn2+)Խ��H2O2�ֽ�����Խ����ȷ�𰸣�c(Mn2+)Խ��H2O2�ֽ�����Խ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��ӵ�����ԭ����sp2�ӻ�����(����)
A. PBr3 B. CH4 C. H2O D. BF3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã�A��B�е缫Ϊ��Ķ��Ե缫��C��DΪ����ʪ��Na2SO4��ֽ���ϵIJ��У���Դ��a��b��������A��B�г���KOH��Һ������KOH��Һ��ˮ���У��ж�K1 �� �ϱ�K2��K3ֱͨ���磬�ش��������⣺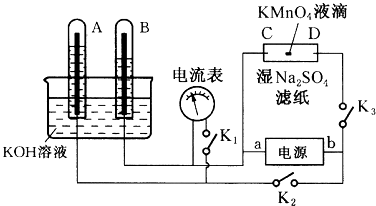
��1���жϵ�Դ��������aΪ����
��2����ʪ��Na2SO4��Һ��ֽ�����ĵ�KMnO4Һ�Σ���һ��ʱ�䣬����Ϊ��
��3�������һ��ʱ���A��B�о��������Χ�缫����ʱ�ж�K2��K3 �� �ϱ�K1 �� ���������ָ��(���ǻ��)ƫת����ƫת�����ʱA���缫��ӦʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ������CuCl2��Һ���Թ��е�������NaOH��Һ���ٵ�������Ũ��ˮ��������������ȷ����(����)
A. ��ʼ������ɫ���������������ˮʱ���γ���ɫ��Һ
B. ��ʼ����Cu(OH)2����������ˮ��������Ũ��ˮ����������ɫ��Һ
C. ��ʼ������ɫ���������백ˮ�����ܽ���������ɫ��Һ
D. ��ʼ����Cu(OH)2��֮�����ɸ��ȶ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦmA(g)��nB(g) ![]() pC(g)�ﵽƽ��������¶ȣ�B��ת���ʱ����Сѹǿ��C�����������С��
pC(g)�ﵽƽ��������¶ȣ�B��ת���ʱ����Сѹǿ��C�����������С��
(1)����>��������������<����գ��÷�Ӧ����H______0��m��n______p��
(2)��������������С���������������(������������)�������¼���B����A��ת����________�������¶ȣ���ƽ��ʱB��C��Ũ��֮��c(B)/c(C)��________�����������ƽ��ʱ��������������ʵ���________��
(3)��A��C��Ϊ��ɫ���壬BΪ��ɫ���壬����������������dz��������������գ������¼���C��ƽ���������ɫ________������ѹ����������ƽ��������ɫ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ÿɹ���ԭ��ء��Իش��������⣺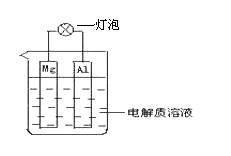
��1���������ҺΪŨ����ʱ������ (�����������, �������a�⣬���������b��)��
a.������������Mg�缫�Ϸ����ķ�ӦΪ�� ��
b.�����ݲ�����������Ϊ��
��2���������ҺΪNaOH��Һʱ������ (�����������, �������a�⣬���������b��)��
a.������������Mg�缫��ӦʽΪ�� ��Al�缫��ӦʽΪ�� ��
b.�����ݲ�����������Ϊ�� ��
��3��(��)��һ�ֽ��ܵ��ȼҵ�¹��գ���������ȼ�ϵ������ϣ����������ͼ��ʾ(�缫δ���)��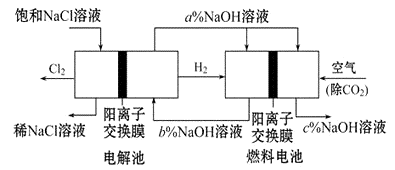
�ش������й����⣺
ԭ��صĸ�����ӦʽΪ��
��4��a��b��c�Ĵ�С��ϵΪ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. ��H�γ�1molH-H��Ҫ��������
B. ����ȼ�շ�Ӧ���Ƿ��ȷ�Ӧ
C. 16g O3�����к��еķ��Ӹ���ΪNA
D. �������ȶ������Ļ�ѧ��Ӧ�������ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com