
【题目】下列说法正确的是( )
A. 由H形成1molH-H键要吸收热量
B. 所有燃烧反应都是放热反应
C. 16g O3单质中含有的分子个数为NA
D. 凡经加热而发生的化学反应都是吸热反应
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭真空容器中,反应2BaO2(s) ![]() 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A. 平衡常数减小 B. BaO量不变 C. 氧气压强不变 D. BaO2量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活中具有重要作用。请按要求回答下列问题:
(1)海带灰浸取液中的碘元素以I-形式存在。现利用如下试剂:MnO2、稀硫酸、淀粉溶液,从中获取单质碘。请按要求完善下表:
序号 | 所选试剂 | 反应原理或现象或解释 |
方法1 | MnO2、稀硫酸 | 离子方程式:________ |
方法2 | 稀硫酸、淀粉溶液 | 溶液变蓝的原因。用离子方程式解释: ____________ |
(2)反应2HI(g) ![]() H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
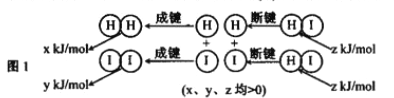

①比较2z______(x+y)(填 “<"、“>”或“=”).
②某温度下该反应的平衡常数K=1/9,达平衡时,HI的转化率=___________。
③只改变该反应的一个条件,试写出能提高HI转化率的两项措施:__________、_________。
(3)已知:i.分解1molH2O2放出热量98kJ;ⅱ.含少量I-的溶液中,H2O2的分解机为: H2O2+I-![]() H2O+IO-慢;H2O2+IO-
H2O+IO-慢;H2O2+IO-![]() H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:
H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:
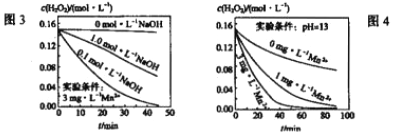
请完善由以上信息可得到的如下结论:
①H2O2分解反应的热化学方程式为___________。
②H2O2的分解速率与_________有关。
③“少量Mn2+存在时,溶液碱性越强H2O2分解速率越大”的结论是否正确_______(填“是"或“否”);c(Mn2+)对H2O分解速率的影响是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在XZ2中,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是

A. 原子半径:W<X<Y B. 非金属性:Y>Z>X
C. Y与Z组成的化合物一定有漂白性 D. W与X组成的化合物中只有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
B | 用乙醇与浓硫酸反应制乙烯,将产生的气体直接通入酸性高锰酸钾溶液中 | 高锰酸钾溶液的紫红色褪去 | 乙烯能被酸性高锰酸钾氧化 |
C | 向装有X溶液的试管中滴入浓NaOH溶液,将干燥的红色石蕊试纸置于试管口 | 无明显现象 | X溶液中无NH4+ |
D | 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者 红色更深 | 结合质子的能力:CO32- > HCO3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度是________。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com