
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度是________。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】(1)0.0035 mol/L;(2) b;1.5×10-3 mol/(L·s);
(3) b、c; (4) b、c、d。
【解析】
试题(1)800℃,反应达到平衡时,NO的物质的量浓度是c(NO)=n÷V=0.007mol÷2L=0.0035 mol/L;(2)NO2是生成物,每消耗2molNO,会产生2molNO2;反应过程消耗的NO的物质的量是n(NO)= 0.020mol-0.007mol=0.0130mol,则反应产生的NO2的物质的量的n(NO2)=0.0130mol,则其浓度是c(NO2)=0.0130mol÷2L=0.0065mol/L,所以在图中表示NO2的变化的曲线是b;从0~2 s内用NO表示的化学反应速率是V(NO)=(0.020-0.008)mol÷2L÷2s=0.003mol/(Ls),由于V(NO):V(O2)=2:1,因此用O2表示从0~2 s内该反应的平均速率V(O2)=1/2 V(NO)= 1.5×10-3 mol/(L·s);(3)a.在任何时刻都存在v(NO2)=2v(O2),因此不能判断反应处于平衡状态,错误;b.由于该反应是反应前后气体体积不等的反应,所以容器内压强保持不变,则反应处于平衡状态,正确; c.v逆(NO):v逆(O2) =2:1;由于 v逆(NO):v正(O2) =2:1 ,所以v逆(O2) = v正(O2);正确;d.由于反映体系都是气体,因此在任何时候,无论反应是否处于平衡状态,容器内密度保持不变,故不能作为判断平衡的标准,错误。(4)a.及时分离出NO2气体,使生成物的浓度减小,则正反应的速率瞬间不变,但后来会随着生成物的浓度的减小,反应物浓度也减小,所以正反应速率减小,错误; b.适当升高温度,会使物质的分子能量增加,反应速率加快,正确; c.增大O2的浓度,会使反应速率大大加快,正确;d.选择高效催化剂,可以使化学反应速率大大加快,正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是( )
A. 开始生成蓝色沉淀,加入过量氨水时,形成无色溶液
B. 开始生成Cu(OH)2,它不溶于水,但溶于浓氨水,生成深蓝色溶液
C. 开始生成蓝色沉淀,加入氨水后,沉淀溶解生成深蓝色溶液
D. 开始生成Cu(OH)2,之后生成更稳定的配合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 由H形成1molH-H键要吸收热量
B. 所有燃烧反应都是放热反应
C. 16g O3单质中含有的分子个数为NA
D. 凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝锰合金可作炼钢脱氧剂。某课外小组欲测定铝锰合金中锰的含量。
I硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的浓度滴定
步骤1:取20.00mL 0.015mol/L K2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加2滴R溶液作指示剂,继续滴定至终点,消耗的体积为V1mL。
步骤2:重复步骤1实验,接近终点时加4滴R溶液,消耗的体积为V2mL.
Ⅱ过硫酸铵[(NH4)2S2O8]催化氧化滴定法测定锰含量
取mg铝锰合金于锥形瓶中,加入适量的浓磷酸,加热至完全溶解,稀释冷却谣匀,再加入少量的硝酸银溶液、过量的过硫酸铵溶液,加热煮沸至无大量气泡冒出,冷却至室温(此时溶液中锰的化合价为+7),用标定的硫酸亚铁铵溶液进行滴定,根据实验数据计算铝锰合金中锰的含量。
[查阅资料]①酸性条件下,Cr2O72-具有很强的氧化性,易被还原为绿色的Cr3+;
②R溶液的变色原理: ![]()
(1)Ⅰ中步骤1.2需要的玻璃仪器有锥形瓶、胶头滴管,_______、________。
(2)Ⅰ中滴定过程,主要反应的离子方程式是________。
(3)Ⅰ中步骤2的主要作用是_________
(4)Ⅱ中硫酸亚铁铵溶液的滴定浓度是_________mol/L (用含V1、V2的代数式表示)。
(5)Ⅱ中加入硝酸银溶液的目的是________。
(6)Ⅱ中若未加热煮沸无大量气泡冒出,锰含量测定结果将_______(填“偏大”“偏小”或“无影响”)。
(7)为了提高该实验的准确度和可靠度,需进行________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应Zn + CuSO4 ═ Cu + ZnSO4 设计一个原电池。
(1) 在下面方格内画出实验装置图________.

(2)指出正极材料可以为_____________, 电极反应式是_______________;负极材料为_____________,电极反应式是_____________________________.
(3)若反应过程中有0.2mol电子通过,则溶解Zn的质量为________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 欲实现铁上镀锌,用锌作阴极
B. 电解精炼铜,若转移2mol电子,阴极质量增加64g
C. 硫酸工业中采用沸腾炉以增大固气接触面积,加快反应速率
D. 镁的提取工业中,MgCl2·H2O在HCl气流中脱水以防止MgCl2水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应可表示为:
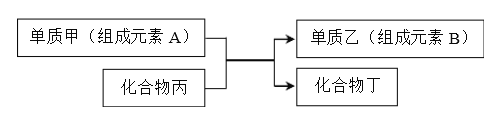
回答下列问题:
(1)下列物质能由化合反应制得,但不能由单质与酸发生置换反应得到的是__________。
A.AgCl B.FeCl2 C.AlCl3 D.FeCl3
(2)若A、B都是短周期元素,且B的原子序数是A两倍。则A在元素周期表中的位置
是_____________。
(3)若乙是一种常见半导体材料,工业上利用上述反应制取乙的化学方程式为____________。
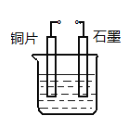
(4)若甲是Cu,乙是H2,某学生设计如图电化学装置实现该置换反应。则铜片为________极(填“正”、“ 负”、“ 阴”、“ 阳”),石墨上的电极反应______________。
(5)若甲是铝,丙是Fe3O4。过量的甲与丙完全反应后,欲从反应产物中分离出单质乙的化学方法是_______________。
(6)Cl2和NH3可发生置换反应。室温下,抽去下图所示装置中的玻璃片,使Cl2和NH3充分反应。
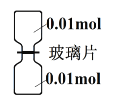
①NH3在___________瓶(填“上”或“下”) ;
②反应中,被氧化的B 元素与未被氧化的B 元素之比是_________;
③反应后取集气瓶壁附着的固体溶于适量水中,所得溶液中各离子浓度由大到小的顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液 ④CH3COONH4溶液各25mL,物质的量浓度均为0.l mol/L,下列说法正确的是( )
A. 四种溶液的pH大小顺序是③>②>①>④
B. 若分别加入25 mL 0.1 mol/L的盐酸充分反应后,pH最大的是①
C. 若将四种溶液稀释相同倍数,pH变化最大的是④
D. 升高温度,③溶液的pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com