
【题目】下列变化中,必须加入还原剂方能实现的是
A.Cl—→Cl2
B.KMnO4→MnO2
C.CuO→Cu
D.CO→CO2
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列自发反应可用焓判据来解释的是( )
A. 氢氧化钡和氯化铵的反应
B. 2N2O5(g)![]() 4NO2(g)+O2(g) H=+56.7 kJ/mol
4NO2(g)+O2(g) H=+56.7 kJ/mol
C. (NH4)2CO3(s)![]() NH4HCO3(s)+NH3(g) H=+74.9 kJ/mol
NH4HCO3(s)+NH3(g) H=+74.9 kJ/mol
D. 2H2(g)+O2(g)![]() H2O(l) H=-285.8 kJ/mol
H2O(l) H=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是( )
A. 开始生成蓝色沉淀,加入过量氨水时,形成无色溶液
B. 开始生成Cu(OH)2,它不溶于水,但溶于浓氨水,生成深蓝色溶液
C. 开始生成蓝色沉淀,加入氨水后,沉淀溶解生成深蓝色溶液
D. 开始生成Cu(OH)2,之后生成更稳定的配合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可构成原电池。试回答下列问题: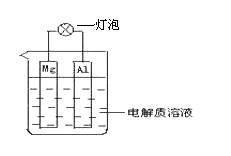
(1)电解质溶液为浓硝酸时,灯泡 (填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的反应为: ;
b.若灯泡不亮,其理由为:
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极反应式为: ;Al电极反应式为: 。
b.若灯泡不亮,其理由为: 。
(3)(Ⅰ)有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出):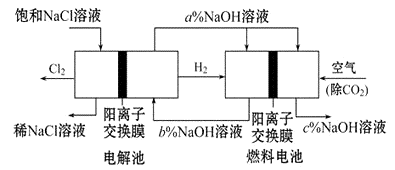
回答下列有关问题:
原电池的负极反应式为。
(4)a、b、c的大小关系为:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4 , 下列说法正确的是( )
A.O4和O2互为同位素
B.O4转化O2为物理变化
C.18O是氧元素的一种核素,它的中子数是8
D.同温同压下,等体积的O4气体和O2含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 由H形成1molH-H键要吸收热量
B. 所有燃烧反应都是放热反应
C. 16g O3单质中含有的分子个数为NA
D. 凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝锰合金可作炼钢脱氧剂。某课外小组欲测定铝锰合金中锰的含量。
I硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的浓度滴定
步骤1:取20.00mL 0.015mol/L K2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加2滴R溶液作指示剂,继续滴定至终点,消耗的体积为V1mL。
步骤2:重复步骤1实验,接近终点时加4滴R溶液,消耗的体积为V2mL.
Ⅱ过硫酸铵[(NH4)2S2O8]催化氧化滴定法测定锰含量
取mg铝锰合金于锥形瓶中,加入适量的浓磷酸,加热至完全溶解,稀释冷却谣匀,再加入少量的硝酸银溶液、过量的过硫酸铵溶液,加热煮沸至无大量气泡冒出,冷却至室温(此时溶液中锰的化合价为+7),用标定的硫酸亚铁铵溶液进行滴定,根据实验数据计算铝锰合金中锰的含量。
[查阅资料]①酸性条件下,Cr2O72-具有很强的氧化性,易被还原为绿色的Cr3+;
②R溶液的变色原理: ![]()
(1)Ⅰ中步骤1.2需要的玻璃仪器有锥形瓶、胶头滴管,_______、________。
(2)Ⅰ中滴定过程,主要反应的离子方程式是________。
(3)Ⅰ中步骤2的主要作用是_________
(4)Ⅱ中硫酸亚铁铵溶液的滴定浓度是_________mol/L (用含V1、V2的代数式表示)。
(5)Ⅱ中加入硝酸银溶液的目的是________。
(6)Ⅱ中若未加热煮沸无大量气泡冒出,锰含量测定结果将_______(填“偏大”“偏小”或“无影响”)。
(7)为了提高该实验的准确度和可靠度,需进行________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应可表示为:
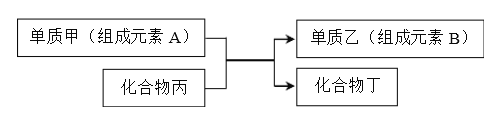
回答下列问题:
(1)下列物质能由化合反应制得,但不能由单质与酸发生置换反应得到的是__________。
A.AgCl B.FeCl2 C.AlCl3 D.FeCl3
(2)若A、B都是短周期元素,且B的原子序数是A两倍。则A在元素周期表中的位置
是_____________。
(3)若乙是一种常见半导体材料,工业上利用上述反应制取乙的化学方程式为____________。
(4)若甲是Cu,乙是H2,某学生设计如图电化学装置实现该置换反应。则铜片为________极(填“正”、“ 负”、“ 阴”、“ 阳”),石墨上的电极反应______________。
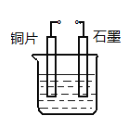
(5)若甲是铝,丙是Fe3O4。过量的甲与丙完全反应后,欲从反应产物中分离出单质乙的化学方法是_______________。
(6)Cl2和NH3可发生置换反应。室温下,抽去下图所示装置中的玻璃片,使Cl2和NH3充分反应。
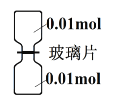
①NH3在___________瓶(填“上”或“下”) ;
②反应中,被氧化的B 元素与未被氧化的B 元素之比是_________;
③反应后取集气瓶壁附着的固体溶于适量水中,所得溶液中各离子浓度由大到小的顺序是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com