
【题目】下列属于电解质的是
A.酒精B.蔗糖C.硝酸钠D.铁丝
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 由H形成1molH-H键要吸收热量
B. 所有燃烧反应都是放热反应
C. 16g O3单质中含有的分子个数为NA
D. 凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应可表示为:
回答下列问题:
(1)下列物质能由化合反应制得,但不能由单质与酸发生置换反应得到的是__________。
A.AgCl B.FeCl2 C.AlCl3 D.FeCl3
(2)若A、B都是短周期元素,且B的原子序数是A两倍。则A在元素周期表中的位置
是_____________。
(3)若乙是一种常见半导体材料,工业上利用上述反应制取乙的化学方程式为____________。
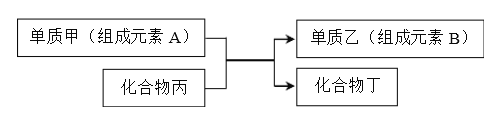
(4)若甲是Cu,乙是H2,某学生设计如图电化学装置实现该置换反应。则铜片为________极(填“正”、“ 负”、“ 阴”、“ 阳”),石墨上的电极反应______________。
(5)若甲是铝,丙是Fe3O4。过量的甲与丙完全反应后,欲从反应产物中分离出单质乙的化学方法是_______________。
(6)Cl2和NH3可发生置换反应。室温下,抽去下图所示装置中的玻璃片,使Cl2和NH3充分反应。
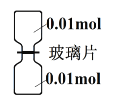
①NH3在___________瓶(填“上”或“下”) ;
②反应中,被氧化的B 元素与未被氧化的B 元素之比是_________;
③反应后取集气瓶壁附着的固体溶于适量水中,所得溶液中各离子浓度由大到小的顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.Fe与S混合加热生成FeS2
B.NaHCO3的热稳定性大于Na2CO3
C.铁与硝酸反应后溶液中一定有Fe3+存在
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢硫酸中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
A. 加水,会使平衡向右移动,溶液中氢离子浓度增大
B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大
D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液 ④CH3COONH4溶液各25mL,物质的量浓度均为0.l mol/L,下列说法正确的是( )
A. 四种溶液的pH大小顺序是③>②>①>④
B. 若分别加入25 mL 0.1 mol/L的盐酸充分反应后,pH最大的是①
C. 若将四种溶液稀释相同倍数,pH变化最大的是④
D. 升高温度,③溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
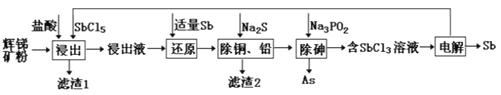
已知:①浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_______________。
(3)“还原”时,被Sb还原的物质为___________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于_________;所加Na2S也不宜过多,其原因为_____________________________。
(5)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_________。
(6)一种突破传统电池设计理念的镁-锑液态金属储能电池工作原理如图所示:
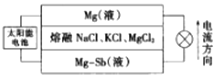
该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,Cl-向_____(填“上”或“下”)移动;放电时,负极的电极反应式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com