
【题目】物质分离提纯是利用物质某些性质差异而进行的行为,下列分离方法利用的物质的主要性质差异不正确的是( )
A.实验室模拟石油分馏:沸点差异B.结晶:温度差异
C.分液:溶解性及密度差异D.过滤:溶解度差异
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】如图所示的化学电源在日常生活和高科技领域中都有广泛应用,有关以上化学电源说法错误的是( )
A. 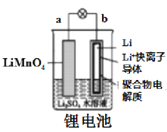 图中:放电时,溶液中Li+从a向b迁移
图中:放电时,溶液中Li+从a向b迁移
B. 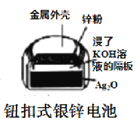 图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
C. 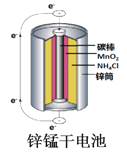 图中:锌筒作负极,发生氧化反应,锌筒会变薄
图中:锌筒作负极,发生氧化反应,锌筒会变薄
D. 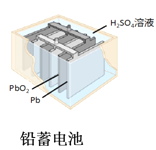 图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究。
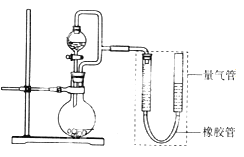
(实验一)探究影响化学反应速率的因素。
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
检查该装置气密性的方法是_______________________________________________。
比较实验I和Ⅱ可以得出的结论是____________________________________________。
(实验二)探究铁的电化学腐蚀。
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面_________右侧液面_________(选填“上升”、“下降”)。
②圆底烧瓶中装与①相同量的铁粉但不加入碳粉,其他试剂和操作相同,发现左、右侧液面变化较_______(选填“快”、“慢”,下同),说明原电池反应比一般化学反应_______。
③圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:___________________________________,正极的电极反应是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含的杂质。选用的试剂正确的是
选项 | 物质(杂质) | 试剂 |
A | Al2O3(SiO2) | 过量NaOH溶液 |
B | CO2(HCl) | 饱和Na2CO3溶液 |
C | Al2O3(Fe2O3) | Al粉/加热 |
D | Na2O2(Na2O) | O2/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下浓度均为0.1 mol·Lˉ1的盐酸和醋酸溶液,下列说法正确的是
A. c(CH3COOˉ)=c(Clˉ)
B. 醋酸溶液的pH小于盐酸
C. 醋酸的电离方程式:CH3COOH=CH3COOˉ+H+
D. 等物质的量浓度、等体积的盐酸与氢氧化钠溶液混合后溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A的蒸汽对氢气的相对密度是15,且能发生银镜反应,F的分子式为C3H6O2。有关物质的转化关系如下:
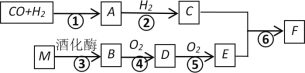
请回答:
(1)B中含有的官能团名称是__________,反应⑥的反应类型为__________。
(2)写出反应④的化学方程式__________。
(3)写出有机物F与NaOH溶液反应的化学方程式__________。
(4)下列说法正确的是__________。
A.有机物D的水溶液常用于标本的防腐
B.有机物B、C、E都能与金属钠发生反应
C.有机物F中混有E,可用饱和碳酸钠溶液进行分离
D.有机物M为高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组研究混有少量氯化钠杂质的纯碱样品,设计如下装置来测定该纯碱样品的纯度。实验步骤如下:
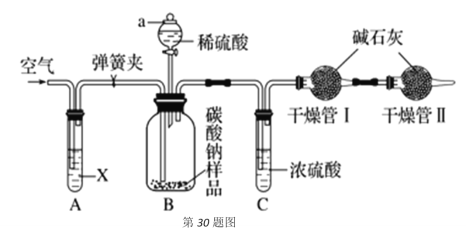
①组装好仪器并检查气密性;
②用托盘天平称量干燥管Ⅰ的质量为m1;
③称量纯碱样品的质量为n,装入广口瓶B内;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤往试管A缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的质量为m2。
请回答:
(1)试剂X是__________,写出广口瓶B中反应的化学方程式__________。
(2)干燥管Ⅱ的作用是__________。
(3)步骤④若滴入稀硫酸过快,会导致测定结果__________(填“偏大”、“偏小”或者“不变”);理由是__________。
(4)根据此实验,计算纯碱样品纯度的为__________(用含m1、m2、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个恒温、恒容密闭容器中,有两个可左右自由滑动的密封隔板(a、b),将容器分成三部分,已知充入的三种气体质量相等,当隔板静止时,容器内气体所占体积如图所示,下列说法中错误的是
![]()
A. 若Y是O2 ,则X可能是CH4 B. 分子数目:X=Z=2Y
C. 若X是N2,则Z可能是CO D. 气体密度:X=Z=2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(为验证卤素单质氧化性的相对强弱,某学习小组用如图所示装置进行实验![]() 夹持仪器已略去,气密性已检验
夹持仪器已略去,气密性已检验![]() .
.
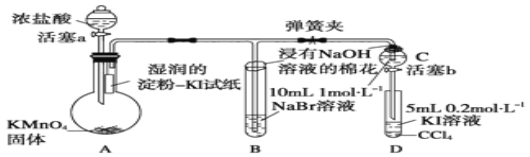
实验过程:
Ⅰ![]() 打开弹簧夹,打开活塞a,滴加浓盐酸.
打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ![]() 当B和C中的溶液都变为黄色时,夹紧弹簧夹.
当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ![]() 当B中溶液由黄色变为棕红色时,关闭活塞a.
当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.......
(1)A中产生黄绿色气体,其电子式是 ______ ;写出实验室制取A中气体的化学方程式___________________
(2)验证氯气的氧化性强于碘的实验现象是 ________________________________ .
(3)B中溶液发生反应的离子方程式是 ____________________________________ .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ___________________________ .
(5)过程Ⅲ实验的目的是 _________________________________________.
(6)实验结论:氯、溴、碘单质的氧化性逐渐 ______,原因是:同主族元素从上到下,原子半径逐渐______,得电子能力逐渐______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com