
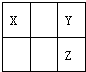
| A、原子的半径:Y大于X |
| B、氢化物的稳定性:X大于Y |
| C、最高价氧化物水化物的酸性:Z强于Y |
| D、Z原子比Y原子多一个电子层 |


科目:高中化学 来源: 题型:
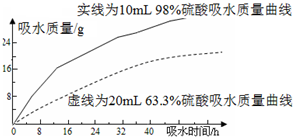 探究浓硫酸的吸水性.某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图.由如图曲线你能得到的实验结论有哪些?(写两点)
探究浓硫酸的吸水性.某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图.由如图曲线你能得到的实验结论有哪些?(写两点)查看答案和解析>>
科目:高中化学 来源: 题型:
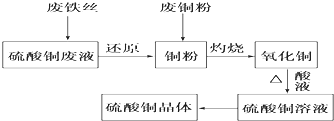
查看答案和解析>>
科目:高中化学 来源: 题型:
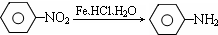 (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)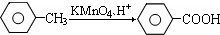
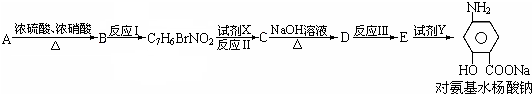
查看答案和解析>>
科目:高中化学 来源: 题型:
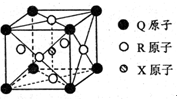 已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子最外层电子数之和.另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子.请回答下列问题.
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子最外层电子数之和.另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
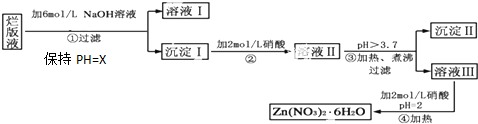
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
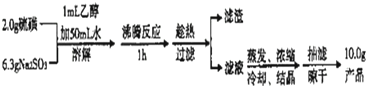
查看答案和解析>>
科目:高中化学 来源: 题型:
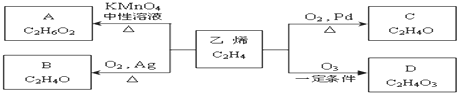
 )化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.
)化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.查看答案和解析>>
科目:高中化学 来源: 题型:
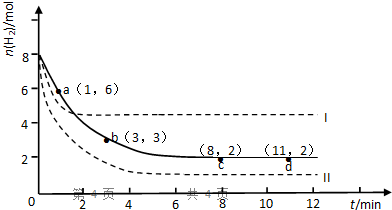
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com