
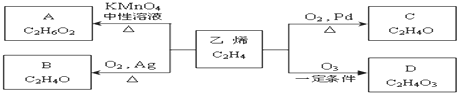
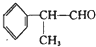
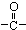 )化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.
)化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.| 1.24g |
| 62g/mol |
| 0.448L |
| 22.4L/mol |
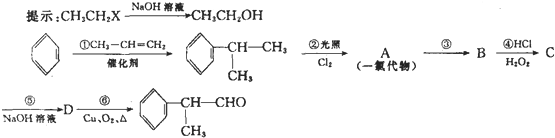
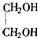 ,由A与B、C的分子式可知,A分子内脱去1分子水生成B、C,而C能发生银镜反应而B不能,结合烯醇很不稳定,很快会发生异构化,形成稳定的羰基化合物,则B为
,由A与B、C的分子式可知,A分子内脱去1分子水生成B、C,而C能发生银镜反应而B不能,结合烯醇很不稳定,很快会发生异构化,形成稳定的羰基化合物,则B为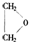 ,C为CH3CHO,乙烯发生氧化反应生成D,D一种同分异构体叫过氧乙酸,该同分异构体结构简式为CH3COOOH.
,C为CH3CHO,乙烯发生氧化反应生成D,D一种同分异构体叫过氧乙酸,该同分异构体结构简式为CH3COOOH.| 1.24g |
| 62g/mol |
| 0.448L |
| 22.4L/mol |
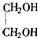 ,由A与B、C的分子式可知,A分子内脱去1分子水生成B、C,而C能发生银镜反应而B不能,结合烯醇很不稳定,很快会发生异构化,形成稳定的羰基化合物,则B为
,由A与B、C的分子式可知,A分子内脱去1分子水生成B、C,而C能发生银镜反应而B不能,结合烯醇很不稳定,很快会发生异构化,形成稳定的羰基化合物,则B为 ,C为CH3CHO,
,C为CH3CHO,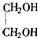 ,B的结构简式为:
,B的结构简式为: ,
,| △ |
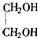 ;
; ;CH3CHO+2[Ag(NH3)2]OH
;CH3CHO+2[Ag(NH3)2]OH| △ |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
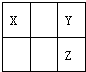
| A、原子的半径:Y大于X |
| B、氢化物的稳定性:X大于Y |
| C、最高价氧化物水化物的酸性:Z强于Y |
| D、Z原子比Y原子多一个电子层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [o] |
| Fe.HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
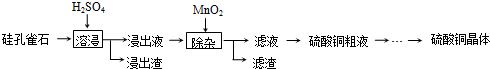
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2用量/g | 收集O2的体积/mL | 反应所需时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ? | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 焙烧 |
| 还原 |
| 电解精炼 |
| ||
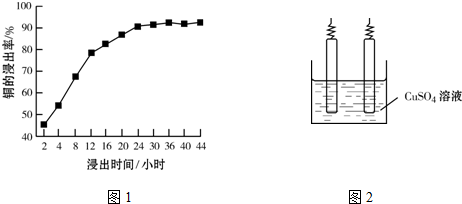
查看答案和解析>>
科目:高中化学 来源: 题型:
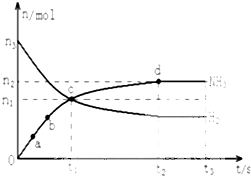 氨气主要用作致冷剂及制取铵盐和氨肥
氨气主要用作致冷剂及制取铵盐和氨肥查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com