
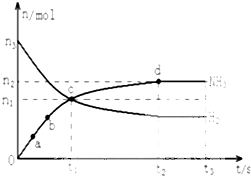
 氨气主要用作致冷剂及制取铵盐和氨肥
氨气主要用作致冷剂及制取铵盐和氨肥| △c |
| △t |
| c2(NH3) |
| c(N2)?c3(H2) |
| 0.6mol/L |
| 3min |
| c2(NH3) |
| c(N2)?c3(H2) |
| (0.4mol/L)2 |
| 0.4mol/L?(1mol/L)3 |


科目:高中化学 来源: 题型:
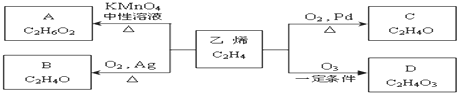
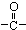 )化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.
)化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.查看答案和解析>>
科目:高中化学 来源: 题型:
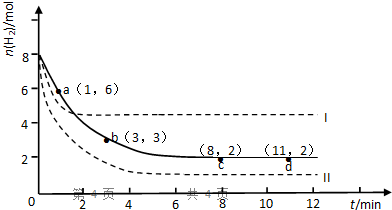
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取5.0 mL浓硫酸并直接在量筒中稀释 |
| B、用嘴吹灭燃着的酒精灯火焰 |
| C、称量NaOH固体时,将药品直接放在托盘上 |
| D、给烧瓶里的液体加热时,垫上石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
| 探究氧化性 | ||
| 探究不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测得0.1mol?L-1醋酸溶液pH大于1 |
| B、相同条件下醋酸与盐酸相比,醋酸导电性弱 |
| C、醋酸溶液的pH比盐酸的pH大 |
| D、等体积相同pH盐酸和醋酸与同浓度NaOH溶液完全反应,醋酸所需NaOH溶液的体积大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com