
| 1000ρw |
| M |
| n |
| V |
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
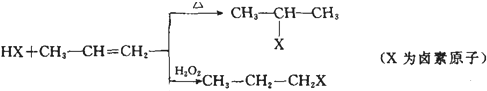
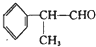
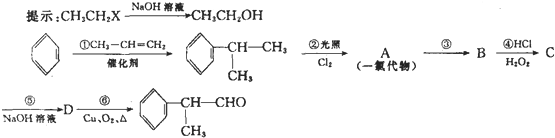
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 |
| B、增加O2的浓度,正反应速率逐渐增大 |
| C、增加SO2的浓度,平衡常数增大 |
| D、若平衡时SO2的浓度比原来大,则平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气主要用作致冷剂及制取铵盐和氨肥
氨气主要用作致冷剂及制取铵盐和氨肥查看答案和解析>>
科目:高中化学 来源: 题型:
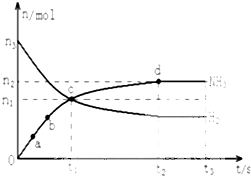
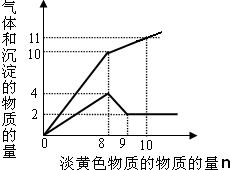 某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是
某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com