
| wg |
| 106g/mol |
| 1000W |
| 53V |
| 1000W |
| 53V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

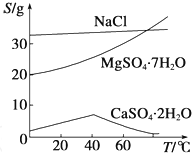
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、容器Ⅰ、Ⅲ中平衡常数相同 |
| B、容器Ⅱ、Ⅲ中正反应速率相同 |
| C、SO3的体积分数:Ⅱ<Ⅲ |
| D、容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 目 的 | 试剂及方法 |
| 证明Na2CO3溶液具有碱性 | |
| 鉴别Na2SO4溶液和(NH4)2SO4溶液 | |
| 检验自来水中是否含有Cl- | |
| 除去FeCl2溶液中少量的FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取5.0 mL浓硫酸并直接在量筒中稀释 |
| B、用嘴吹灭燃着的酒精灯火焰 |
| C、称量NaOH固体时,将药品直接放在托盘上 |
| D、给烧瓶里的液体加热时,垫上石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:
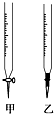 某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.04 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.58 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离出的c(H+):①>③ |
| B、③稀释到原来的100倍后,pH与④相同 |
| C、①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH) |
| D、②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com