
| 实 验 目 的 | 试剂及方法 |
| 证明Na2CO3溶液具有碱性 | |
| 鉴别Na2SO4溶液和(NH4)2SO4溶液 | |
| 检验自来水中是否含有Cl- | |
| 除去FeCl2溶液中少量的FeCl3 |
| 实 验 目 的 | 试剂及方法 |
| 证明Na2CO3溶液具有碱性 | B |
| 鉴别Na2SO4溶液和(NH4)2SO4溶液 | D |
| 检验自来水中是否含有Cl- | C |
| 除去FeCl2溶液中少量的FeCl3 | A |


科目:高中化学 来源: 题型:
| △ |
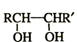
| HIO4 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
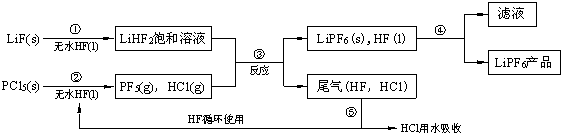
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 |
| B、增加O2的浓度,正反应速率逐渐增大 |
| C、增加SO2的浓度,平衡常数增大 |
| D、若平衡时SO2的浓度比原来大,则平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、混合气体的体积 |
| C、各气体物质的物质的量浓度 |
| D、气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
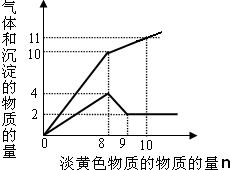 某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是
某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com