
| A、混合气体的压强 |
| B、混合气体的体积 |
| C、各气体物质的物质的量浓度 |
| D、气体的总物质的量 |


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
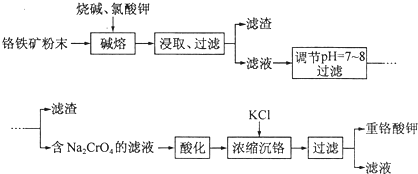
查看答案和解析>>
科目:高中化学 来源: 题型:
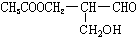 有光学活性,发生下列反应后生成的有机物仍有光学活性的( )
有光学活性,发生下列反应后生成的有机物仍有光学活性的( )| A、与甲酸发生酯化反应 |
| B、与NaOH水溶液共热 |
| C、与足量的氧气作用 |
| D、在催化剂存在下与氢气作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
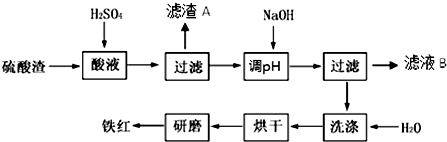
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 目 的 | 试剂及方法 |
| 证明Na2CO3溶液具有碱性 | |
| 鉴别Na2SO4溶液和(NH4)2SO4溶液 | |
| 检验自来水中是否含有Cl- | |
| 除去FeCl2溶液中少量的FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应是焓变为正值 | |||
| B、增大压强,H2浓度一定减小 | |||
| C、升高温度,逆反应速率减小 | |||
D、该反应化学方程式为CO+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
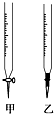 某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.04 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.58 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、1:1 | B、1:5 |
| C、1:2 | D、2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com