
| A、用量筒量取5.0 mL浓硫酸并直接在量筒中稀释 |
| B、用嘴吹灭燃着的酒精灯火焰 |
| C、称量NaOH固体时,将药品直接放在托盘上 |
| D、给烧瓶里的液体加热时,垫上石棉网 |
科目:高中化学 来源: 题型:
| [o] |
| Fe.HCl |
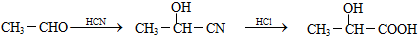
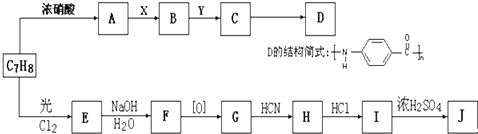
查看答案和解析>>
科目:高中化学 来源: 题型:
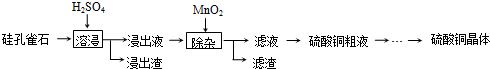
| 焙烧 |
| 还原 |
| 电解精炼 |
| ||
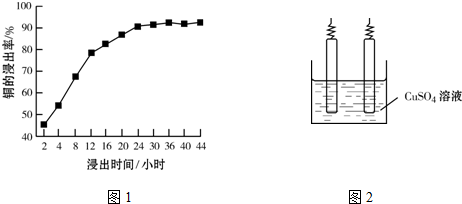
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 |
| B、增加O2的浓度,正反应速率逐渐增大 |
| C、增加SO2的浓度,平衡常数增大 |
| D、若平衡时SO2的浓度比原来大,则平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤⑥ | B、①②③⑤ |
| C、②③④⑥ | D、以上全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气主要用作致冷剂及制取铵盐和氨肥
氨气主要用作致冷剂及制取铵盐和氨肥查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com