
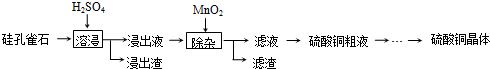
| 焙烧 |
| 还原 |
| 电解精炼 |
| ||
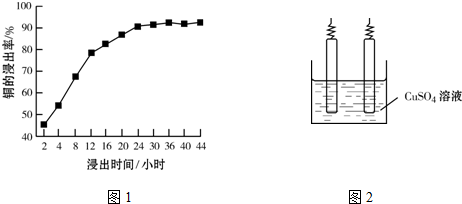
| ||
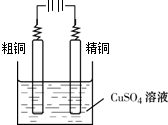 .
.


科目:高中化学 来源: 题型:
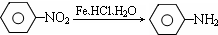 (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)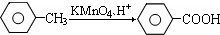
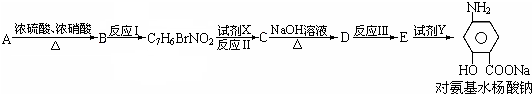
查看答案和解析>>
科目:高中化学 来源: 题型:
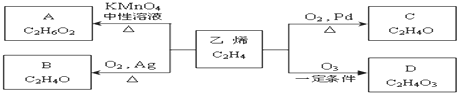
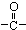 )化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.
)化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.查看答案和解析>>
科目:高中化学 来源: 题型:
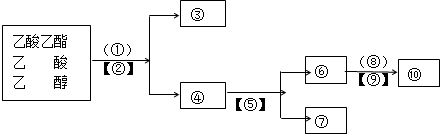
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、容器Ⅰ、Ⅲ中平衡常数相同 |
| B、容器Ⅱ、Ⅲ中正反应速率相同 |
| C、SO3的体积分数:Ⅱ<Ⅲ |
| D、容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
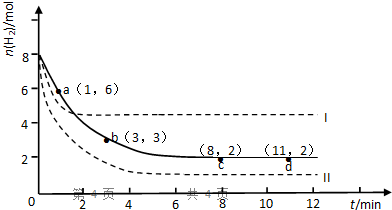
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取5.0 mL浓硫酸并直接在量筒中稀释 |
| B、用嘴吹灭燃着的酒精灯火焰 |
| C、称量NaOH固体时,将药品直接放在托盘上 |
| D、给烧瓶里的液体加热时,垫上石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com