
| A、过滤 | B、蒸馏 | C、分液 | D、萃取 |


科目:高中化学 来源: 题型:
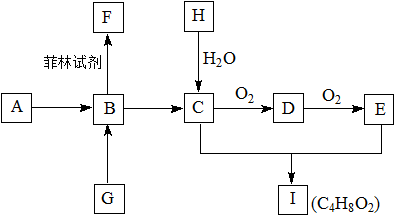
查看答案和解析>>
科目:高中化学 来源: 题型:
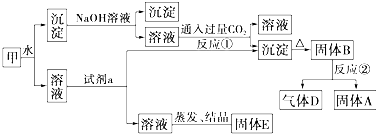
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2用量/g | 收集O2的体积/mL | 反应所需时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ? | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
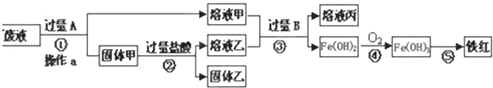
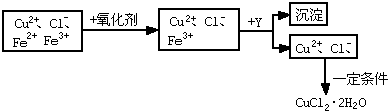
查看答案和解析>>
科目:高中化学 来源: 题型:
| 焙烧 |
| 还原 |
| 电解精炼 |
| ||
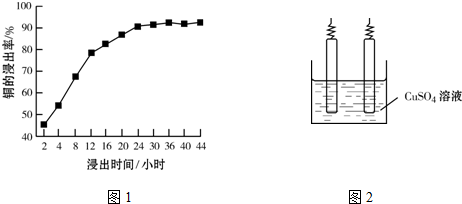
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤⑥ | B、①②③⑤ |
| C、②③④⑥ | D、以上全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该配合物中中心原子(离子)的电荷数和配位数均为6 |
| B、该配合物可能是平面正方形结构 |
| C、Cl- 和NH3分子均与中心原子(离子)形成配位键 |
| D、配合物中心原子(离子)与Cl-形成配位键,而与NH3分子不形成配位键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com