
| 实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
| 探究氧化性 | ||
| 探究不稳定性 |
| 0.85cV |
| 10.00mL×ρg/mL |
| 0.085cV |
| ρ |
| 0.085cV |
| ρ |
| 实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
| 探究氧化性 | 淀粉碘化钾溶液 | 溶液变蓝 |
| 探究不稳定性 | 二氧化锰 | 产生能使带火星的木条变蓝的气体 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
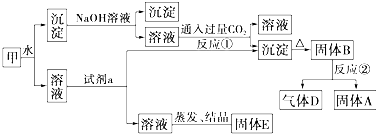
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤⑥ | B、①②③⑤ |
| C、②③④⑥ | D、以上全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去水中的Na+、SO42-、Cl-等杂质可用蒸馏的方法 |
| B、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
| C、用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色,则原溶液含有钠盐 |
| D、某溶液加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气主要用作致冷剂及制取铵盐和氨肥
氨气主要用作致冷剂及制取铵盐和氨肥查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该配合物中中心原子(离子)的电荷数和配位数均为6 |
| B、该配合物可能是平面正方形结构 |
| C、Cl- 和NH3分子均与中心原子(离子)形成配位键 |
| D、配合物中心原子(离子)与Cl-形成配位键,而与NH3分子不形成配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在冷的浓H2SO4溶液中可钝化 |
| B、在潮湿的空气中放置不易生锈 |
| C、熔点比钢高 |
| D、硬度比生铁大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com