
【题目】下图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是 ( )

A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:Z>W>X>Y
C. W的最高正化合价与负化合价的绝对值可能相等
D. 若X位于第VA族,则沸点:XH3<WH3
【答案】C
【解析】如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,由于ⅡA、ⅢA族在周期表中之间相隔10列,故Z至少处于ⅢA族,Y最多处于ⅦA,且X、Y处于第二周期,Z、W处于第三周期;A.根据同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径:Z>W>X>Y,A错误;B.根据同周期元素从左到右非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱,且元素的非金属性越强,对应氢化物的稳定性越大,则气态氢化物的稳定性:Y>X>W>Z,B错误;C.如W为Si,则四种元素分别为C、N、Al、Si,W的最高正化合价与负化合价的绝对值相等,C正确;D.若X位于第VA族,由于氨气分子间存在氢键,则沸点:XH3>WH3,D错误,答案选C。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池中通入CH4电极的电极反应为___________________________________。
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”或“阴极”、“阳极”), 乙池中总反应式为____________________________________ 。
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为______mL(标准状况),丙池中______(填“C”或“D”)极析出_______g铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是
A.SiO2和干冰的熔化 B.氧化钠和钠的熔化
C.晶体硅和晶体硫的熔化 D.碘和干冰的气化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 ![]() (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A.![]() (NH3) = 0.010 mol/(L·s)
(NH3) = 0.010 mol/(L·s)
B.![]() (O2) = 0.0010 mol/(L·s)
(O2) = 0.0010 mol/(L·s)
C.![]() (NO) = 0.0010 mol/(L·s)
(NO) = 0.0010 mol/(L·s)
D.![]() (H2O) = 0.045 mol/(L·s)
(H2O) = 0.045 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 分子晶体中都存在共价键
B. F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关
C. 氯元素含氧酸酸性 HClO > HClO2
D. 只要是离子化合物,其熔点一定比共价化合物的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为____________________。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为_______________。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于_________________。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为___________,中心原子杂化类型为_________。
(5)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为_______ (填序号)。
(6)Cl2和水能发生反应,生成物中有一种为三原子分子,写出该化合物的电子式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有广阔的海岸线,海水综合利用大有可为。海水中溴含量为 65 mg/L,从海 水中提取溴的工业流程如下:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:_____。
(2)步骤Ⅱ通入热空气或水蒸气吹出 Br2,利用了溴的________。
A.氧化性B.还原性C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:_____
![]()
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出 溴与二氧化硫水溶液反应的离子方程式:________。由此反应可知, 除环境保护外,在工业生产中应解决的主要问题是_______。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.氢氧化钠溶液 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式__________。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理___________?并说明理由:________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置B中所装药品为_____________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(4)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加Na2SiO3,观察到C中的实验现象为有白色沉淀物生成。离子方程式为____________________(假设所通气体是过量的)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的基础有机化工原料.工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:C6H5-CH2CH3(g)![]() C6H5-CH=CH2(g) +H2(g)ΔH=a kJmol﹣1
C6H5-CH=CH2(g) +H2(g)ΔH=a kJmol﹣1
(1)向体积为VL的密闭容器中充入n mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
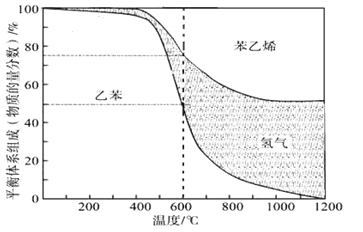
600℃时,该反应的平衡常数_____________。
(2)乙苯在特定催化剂下发生氧化脱氢:
C6H5-CH2CH3(g)+1/2O2(g)![]() C6H5-CH=CH2(g)+H2O(g) ΔH1
C6H5-CH=CH2(g)+H2O(g) ΔH1
已知 H2的燃烧热ΔH= b kJ/mol,水的汽化热为c J/g,则 ΔH1=____________。
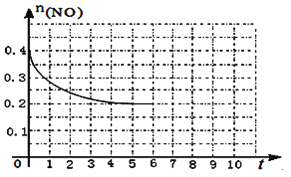
(3)在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。
N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。
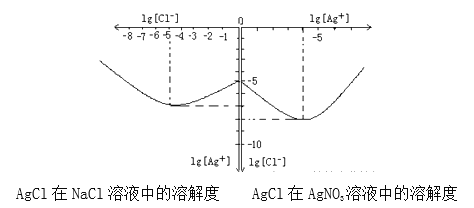
(4)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
①由图知该温度下AgCl的溶度积常数为_________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com