
| A、71 g氯相当于2 mol氯 |
| B、每摩尔物质中含有6.02×1023个原子 |
| C、阿伏加德罗常数为12 g 12C所含的碳原子数 |
| D、1 mol KClO3中含有3 mol氧元素 |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、(a-b)mol | ||
| D、b mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
| A、①② | B、②③ | C、①②④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池负极发生氧化反应 |
| B、电解池阳极发生还原反应 |
| C、通电后,电解池中阳离子向阴极移动 |
| D、原电池中电子从负极沿导线流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na+2H2O=2NaOH+H2↑ |
| B、2Na2O2+2H2O=4NaOH+O2↑ |
| C、3NO2+H2O=2HNO3+NO |
| D、2Cl2+2H2O=4HCl+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
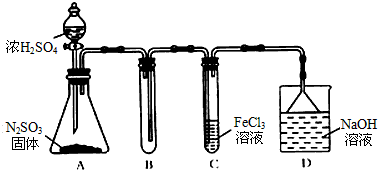
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com