


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、71 g氯相当于2 mol氯 |
| B、每摩尔物质中含有6.02×1023个原子 |
| C、阿伏加德罗常数为12 g 12C所含的碳原子数 |
| D、1 mol KClO3中含有3 mol氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,18gH2O所含原子数为NA |
| B、常温常压下,11.2L氧气含原子数为NA |
| C、2.3g金属钠变为钠离子失去0.1NA电子 |
| D、在同温同压时,相同体积的任何气体单质都含有相同数目的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、中子数为20的氯原子:
| ||||
| B、硫酸的电离方程式:H2SO4=H22++SO42- | ||||
| C、漂白粉的有效成分:CaCl2 | ||||
D、铝离子结构示意图: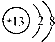 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
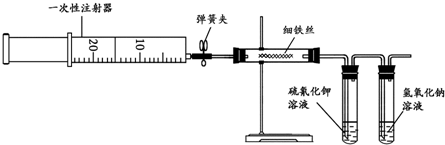
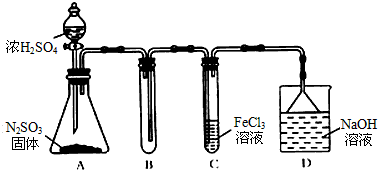
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物 七氧化二锰 Mn2O7 |
| B、酸性氧化物 干冰 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com